Выбор способа управления качеством кристаллического карбамида в промышленных аппаратах
Аннотация
В данной работе проведен анализ современных исследований кристаллического роста карбамида. Получены экспериментальные данные по влиянию добавок на пересыщение, а так же температуры и гидродинамических условий на скорость кристаллического роста. Выбраны наиболее целесообразные способы управления процессом кристаллизации в промышленных аппаратах.
Ключевые слова: Кристаллизация, карбомид, пересыщение, гидродинамические условия.
Детальное изучение процесса кристаллизации карбамида – важное направление для исследований по нескольким причинам, одна из которых – то, что простая структура карбамида может служить моделью для изучения кристаллизации полярных органических веществ, другая – полученные данные могут быть использованы для оптимизации стадии кристаллизации /1/ и существенно улучшить технико-экономические показатели производства карбамида.
Моделирование кристаллической формы органических молекул является актуальной задачей для исследователей кристаллизации. Способность соединений с разной внутренней кристаллической структурой кристаллизоваться в разнообразные формы связано с важными закономерностями физики и химии твердого тела и зависит от внешних параметров, таких как пересыщение, гидродинамические условия и т.п.
Кристаллизация является важной стадией в технологии карбамида. Наличие в кристаллическом карбамиде мелкой фракции вызывает отложение пыли на стенках пневматического конвейера, циклонов, воздуховодов, лопастях рабочих колес вентиляторов, и как следствие возникает необходимость периодической промывки системы. Кроме того, велики потери карбамида, связанные с уносом пыли из циклонов.
Существенной проблемой является интерпретация экспериментальных, данных полученных в лабораторных условиях применительно к промышленным кристаллизаторам. На сегодняшний день разработано большое количество моделей, предназначенных для прогнозирования габитуса и скорости роста граней кристаллов карбамида.
Каждая молекула карбамида O=C(NH2)2 может быть вовлечена в 6 разных взаимодействий с помощью водородных связей, и это является примером, структуры, в которой единственный карбонильный кислородный атом принимает участие в образовании четырех водородных связей в форме N-H∙∙∙O=C. При росте из водных растворов карбамид кристаллизуется в виде длинных тонких призм с отношением высоты профиля к его ширине около 8,0 /2/. С начала возникновения квантового химического моделирования, как об этом сообщают Бук, Дочерти и др. /3, 4/ стало возможным предсказывать форму кристаллов в хорошем приближении к наблюдаемой морфологии кристаллов, выращенных из паровой фазы.
Карбамид кристаллизуется тетрагональными нестехиометрическими ![]() пространственными группами, с двумя молекулами в элементарной ячейке (a = 5,5576 Å, c = 4,684 Å) как показано на рисунке 1. Элементарная ячейка кристалла содержит две молекулы, сопряженных как:
пространственными группами, с двумя молекулами в элементарной ячейке (a = 5,5576 Å, c = 4,684 Å) как показано на рисунке 1. Элементарная ячейка кристалла содержит две молекулы, сопряженных как:
M(1): 0,000; 0,500; z. и M(2): 0,500; 0,000; 1 – z,
Центр масс М (1) это: xc = 0,0000; yc = 0,5000; zc = 0,3154
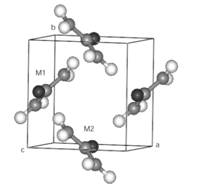
Рисунок 1. Элементарная ячейка кристалла карбамида.
Межмолекулярные связи были рассчитаны в работе /5/ с помощью программы Хабита, а параметры поля сил были получены из работ Хеглера, Лифсона и соавторов /6, 7/. Сумма всех молекулярных взаимодействий посредством потенциального метода атом-атом (суммирование Эвалда) равна энергии решетки. Энергия решетки была рассчитана в работе /5/ Elatt = - 22,57 ккал/моль, значение сравнимо с экспериментальной энтальпией сублимации ΔHsub = 21,0 Ккал/моль. Суммарный ограничивающий радиус был определен r = 30Å.
Боек, Бриелс и Фил в своей работе /8/ по исследованию координации молекул на границе раздела фаз между кристаллом и насыщенным раствором, доказали, что карбамид обладает более высокой способностью к адсорбции, чем вода. Было показано, что распределение в горизонтальной плоскости молекул карбамида в первом слое адсорбции различно для граней 001 и 110. Предполагается, что при небольших пересыщениях рост кристалла происходит по механизму спирали и только с увеличением пересыщения по двухмерному механизму, в работе /8/ продемонстрировано, что даже при небольших пересыщениях превалирует механизм двухмерного роста. Доказано, что традиционная модель Косселя по блочному росту кристаллов не эффективна, и необходимо учитывать молекулярные взаимодействия на границе раздела фаз.
Веред Бискер-Либ и Майкл Ф. Доэрти в своей работе /9/ показали, как влияет природа растворителя на конечную форму кристаллов, описали особенности межмолекулярных взаимодействий, возникающих в процессе формирования кристаллической структуры, и уточнили энергетический баланс. Авторами было проведено сравнение результатов по предсказанию формы кристаллов на основе разных моделей, наилучшие результаты были получены с использование детального механизма Бартона, Карберы и Франка (BCF) с учетом данных по взаимодействию растворитель - растворенное вещество. Применение этого метода показало хорошие результаты в предсказании формы тонких длинных призм, которые наблюдаются в лабораторных экспериментах при кристаллизации карбамида из водных растворов. Модели Брависа-Фриделя-Доннея-Харкера (BFDH) и энергий взаимодействия дают не достаточно достоверные результаты при прогнозировании формы получаемых кристаллов.
В. Фила и Дж. Гарсайд в своей работе /2/ о влияние биурета на кинетику роста кристаллов карбамида из водных растворов, продемонстрировали, что присутствие примеси снижает скорость роста, но воздействие на различные грани не одинаково. Наибольший эффект снижения скорости роста фиксируется на грани 001, а на грани 110 эффект незначительный. Описанное явление приводит к изменению формы кристаллов. В работе было наглядно проиллюстрирован механизм встраивания молекулы биурета в кристалл карбамида, и количественно оценено влиянии концентрации биурета при различных величинах пересыщения σ. Так при σ = 0,005 концентрация биурета достаточная для ингибирования роста грани 001, составляет 0,5% массовых, а при σ = 0,0085 эффект достигается только при содержании биурета 6,3 % массовых.
Анализ современных исследований кристаллического роста карбамида показал, что большинство результатов получены при температурах не превышающих 25°С, или в условиях политермической кристаллизации. В производстве карбамида процесс кристаллизации ведут при температурах выше 60°С, поэтому с целью наилучшей интерпретации экспериментальных и теоретических данных для использования в промышленности, необходимо рассмотреть влияние температуры на скорость кристаллического роста.
Исследования были проведены в два этапа:
- Оценка влияния на пересыщение скорости охлаждения и присутствия примесей характерных для промышленного производства карбамида.
- Исследование кинетики кристаллического роста в условиях массовой кристаллизации при изотермическом режиме.
Первый этап исследований проводили на лабораторной установке, включавшей кристаллизатор с рубашкой, перемешивающее устройство пропеллерного типа, термостат с программируемым охлаждением жидкости и подачей ее в рубашку кристаллизатора, устройство для регулирования и измерения числа оборотов мешалки.
В опытах использовали приготовленный непосредственно в кристаллизаторе 70%-ный раствор карбамида. Скорость охлаждения составляла 0,1 – 0,2°С в минуту, перепад температур 1,7 – 5,9°С, конечная температура кристаллизации составляла 50,7 – 53,3°С, число оборотов мешалки 15-20 об/сек.
Максимальное пересышение определяли по формуле:
σ = (Ср-ра-Снас)/Снас; где Ср-ра – концентрация исследуемого раствора, Снас – концентрация насыщения, при которой было зафиксировано начало кристаллизации.
Наибольшее максимальное пересышение было зафиксировано при скорости охлаждения 0,78 град/мин, составило σ = 0,0219. Характер зависимости переохлаждения от скорости охлаждения представлен на рисунке 2. При увеличении скорости охлаждения растет и максимальное пересыщение, пока не достигает граничного значения, дальнейшее увеличение скорости охлаждения не приводит к значимым результатам.
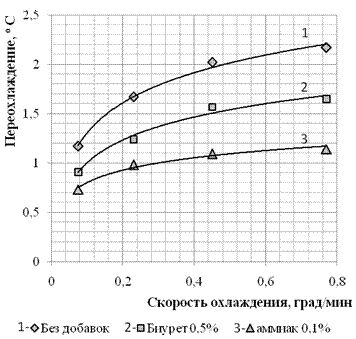
Рисунок 2. Влияние скорости охлаждения на величину переохлаждения.
Присутствие добавок значительно уменьшает величину максимального пересыщение, не меняя характер зависимости от скорости охлаждения.
На следующем этапе работы было определено влияние температуры на скорость кристаллического роста, при температурах близких к промышленным условиям 40, 50 и 60°С в изотермическом режиме.
Для проведения исследований была создана лабораторная установка непрерывной кристаллизации, показанная на рисунке 3, включавшая в себя: трубку отвода суспензии из реактора с регулятором расхода 1, реактор с рубашкой 2; термостат 3, электронный термометр 4, мешалка пропеллерного типа с блоком регулирования и контроля скорости вращения 5, перистальтический насос 6 для подачи более концентрированного раствора, термометр 7, емкость с раствором 8, магнитная мешалка с подогревом 9.
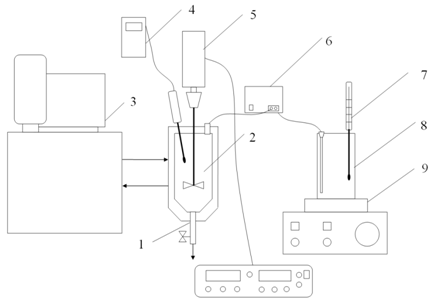
Рисунок 3. Схема экспериментальной установки для исследований кристаллизации в изотермическом режиме.
Эксперименты проводили следующим образом /10/. Раствор карбамида в реакторе с рубашкой нагревали при помощи термостата до температуры насыщения и вносили кристаллы затравки. Далее для создания постоянного пересыщения, при помощи перистальтического насоса в реактор подавали раствор карбамида более высокой концентрацией. Для подержания постоянного уровня в кристаллизаторе при помощи трубки осуществляли непрерывный отбор суспензии. По истечении заданного времени, которое обеспечивало полную смену объема кристаллизатора, полученную суспензию подавали на термостатируемый фильтр и отфильтровывали вакуум-насосом при температуре равной температуре кристаллизации. После фильтрации кристаллы высушивали на воздухе. Для предотвращения сращивания кристаллов во время фильтрации промывали ацетоном.
Экспериментальное определение скорости роста η(l) или η(v) проводили двумя методами: по приросту массы навески монодисперсных кристаллов во взвешенном слое и по известному фракционному составу кристаллов.
При проведении исследований на монодисперсной затравке скорость роста η(v) (объёмная)определяется взвешиванием навески до и после эксперимента и рассчитывается по уравнению /11/:
η(v)= ΔM∙V0 /3M0 Δτ
где ΔM — приращение массы затравочных кристаллов M0за время Δτ; V0 — начальный объём затравочных кристаллов.
Для аппаратов идеального смешения функция распределения имеет вид (в случае, если скорость роста не зависит от размера) /12/:![]()
где, ![]() – плотность распределения кристаллов по линейным размерам;
– плотность распределения кристаллов по линейным размерам; ![]() – линейная скорость роста;
– линейная скорость роста; ![]() – плотность распределения зародышей; τ – время.
– плотность распределения зародышей; τ – время.
Прологарифмировав выражение, получаем:![]()
Таким образом, если отложить по оси ординат lnf , а по оси абсцисс размер кристаллов l, то тангенс угла наклона будет равен
tgγ= –1/ητ.
Из данного уравнения определяли скорость роста.
Зависимости скорости роста кристаллов от параметров процесса кристаллизации, найденные путем обработки экспериментальных данных, приведены в таблицах 1 и 2.
|
Т,°С |
Пересыщение σ |
η(v) (мкм3/с) при | ||
|
скорость вращения | ||||
|
1000 |
1250 |
1500 | ||
|
40 |
0,005 |
0,0040 |
0,0047 |
0,0049 |
|
0,015 |
0,0059 |
0,0062 |
0,0066 | |
|
50 |
0,005 |
0,0049 |
0,0060 |
0,0067 |
|
0,015 |
0,0068 |
0,0077 |
0,0081 | |
|
60 |
0,005 |
0,0058 |
0,0065 |
0,0079 |
|
0,015 |
0,0074 |
0,0082 |
0,0092 | |
|
Т,°С |
Пересыщение σ |
Скорость линейного роста η(l) (мкм/с) | ||
|
скорость вращения | ||||
|
1000 |
1250 |
1500 | ||
|
40 |
0,005 |
0,285 |
0,247 |
0,207 |
|
0,015 |
0,256 |
0,228 |
0,169 | |
|
50 |
0,005 |
0,242 |
0,222 |
0,181 |
|
0,015 |
0,261 |
0,216 |
0,178 | |
|
60 |
0,005 |
0,221 |
0,206 |
0,194 |
|
0,015 |
0,242 |
0,211 |
0,175 | |
Анализ приведенных в таблицах данных позволяет сделать следующие выводы. Повышение температуры и интенсивности перемешивания приводит к увеличению средней объемной скорости роста кристаллов карбамида, что связано, по-видимому, с преобладающим диффузионным механизмом кристаллического роста. Однако средняя линейная скорость роста кристаллов карбамида снижается с повышением температуры и интенсивности перемешивания. Этот факт может быть объяснен, если предположить различное влияние этих параметров на скорость линейного роста кристаллов карбамида в различных кристаллографических направлениях. С другой стороны влияние скорости перемешивания носит экстремальный характер, следовательно, необходимо учесть разрушение кристаллов, причем с увеличением температуры возрастает их хрупкость, и как следствие изометричность кристаллов тоже увеличивается.
На основании анализа описанных в литературе закономерностей процесса кристаллизации и результатов проведенных нами исследований, в качестве целесообразных способов управления свойствами кристаллического карбамида предложено.
- Вести контроль содержания биурета в маточном растворе и поддерживать его на постоянном уровне. Это позволит существенно снизить скорость роста грани 001, что при сохранении средней объемной скорости роста увеличит степень изометричности кристаллов .
- Усилить перемешивание в кристаллизационной части, что в связи преобладающим диффузионным механизмом кристаллического роста существенно увеличит скорость роста.
- Снизить температуру в кристаллической части с 70 С° до 60 С°, что снизит хрупкость кристаллов и, как следствие, содержание пылевидной фракции в кристаллическом карбамиде.
Список использованной литературы:
- 1.Исаев В.Н. Самарский А.П. Сливченко Е.С. Цатуров В.А.// Изв. вузов. Химия и хим. технология. 2008, Т. 51, №. 6 Стр. 63-65Isaev V.N., Samara A.P., Slivchenko E.S., Tsaturov V.A. // Izv. Vyssh. Uchebn. Zaved., Khim. Khim. Tekhnol. 2008. V. 51. N 6. P. 63-65.
2.Дэви Р., Фила У., Гарсайд Дж. // Рост кристаллов 1986, Т. 79, Стр.607-613;Davey R., Fila W., Garside J. // J. Cryst. Growth 1986, V 79, P.607-613.
3.Дочерти Р., Робертс К.Дж., Сандерс В., Блэк С., Дэви Р. // Дискуссия Фарадея 1993, Т. 95, Стр. 11-25;Docherty R., Roberts K. J., Saunders V.; Black S., Davey R. J. // Faraday Discuss. 1993, V. 95, Р. 11-25.
4.Бук И.С., Фил Д., Блиелс У.Дж., Бинемма П. // Рост кристаллов 1991, Т. 114, Стр. 389-410;Boek E. S., Feil D., Briels W. J., Bennema P. J. // Cryst. Growth 1991, V. 114, Р. 389-410.
5.Клайдсдеил Г., Дочерти Р., Робертс К.Дж., // Компьютерная физика 1991, Т. 64, Стр. 311-328;Clydesdale G., Docherty R., K. J. Roberts // Comput. Phys.Commun. 1991, V. 64, Р. 311-328.
6.Хаглер А.Т., Элер И., Лифсон С., // Журнал американского химического сообщества 1974, Т. 96, Стр. 5319-5335;Hagler A. T., Euler E., Lifson S.// J. Am.Chem. Soc. 1974, V.96, Р.5319-5335.
7.Лифсон С., Хаглер А.Т., Даубер, П. // Журнал американского химического сообщества 1979, Т. 101, Стр. 5111-5121;Lifson S., Hagler A. T., Dauber P. // J. Am. Chem. Soc. 1979, V.101, Р.5111-5121.
8.Бук И.С., БлиелсУ.Дж., Фил Д.// Физическая химия 1994, Т. 98, Стр. 1674-1681;E. S. Boek, W. J. Briels, and D. Feil // J.Phys.Chem. 1994, V.98, Р.1674-1681.
9.Веред Бискер-Лиеб и Майкал Ф. Доэрти // Кристаллический рост и моделирование, 2001, Т. 1, №. 6, Стр. 455-461; Vered Bisker-Leib and Michael F. Doherty. // Cryst.Growth & Design, 2001, Vol. 1, №. 6, Р. 455-461.
10.Лановецкий С.В., Пойлов В.З., Сизякина А.М., Косвинцев О.К., Степанов А.В.// Изв. вузов. Химия и хим. технология. 2011. Т. 53. № 2. С. 49-53. Izv. Vyssh. Uchebn. Zaved., Khim. Khim. Tekhnol. 2011. V. 53. N 2. P. 49-53.Lanovetsky S.V., Poyle V.Z., Sizyakina A.M., Kosvintsev D.C., StepanovA.V.
11.Веригин А.Н., Щукляк И.А., Михалев М.Ф. Кристаллизация в дисперсных системах. Л.: Химия, 1986. 248 с.Verigin A.N., Schuklyak I.A.,, Mikhalev, MF Crystallization in Disperse systems. L.: Chemistry, 1986. 248c .
12.Кафаров В.В., Кольцова Э.М., Дорохов И.Н. Системный анализ процессов химической технологии. М.: Наука, 1988. 367с.Kafarov V.V., Koltsov E.M., Dorokhov I.N., System analysis of chemical technology processes. Moscow: Science