Изучение возможности катодной интеркаляции щелочных металлов в платину под действием переменного импульсного тока
Аннотация
В работе исследован процесс катодной интеркаляции щелочных металлов в платину под действием переменного импульсного тока из водных и неводных растворов, содержащих катионы щелочного металла. С помощью метода импульсной хронопотенциометрии установлено, что процессы, протекающие при катодной поляризации платины как в водных (щелочных и нейтральных), так и в неводных электролитах включают электрохимическую адсорбцию молекул растворителя и интеркаляцию в адсорбционный слой ионов щелочного металла. При этом интеркаляция в окисленную поверхность платины протекает легче, чем в чистую платину.
Ключевые слова: Катодная интеркаляция, интеркаляционная емкость, платина.Ключевые слова:
05.17.03 - Технология электрохимических процессов и защита от коррозии
Явление электрохимического диспергирования металлов в щелочных растворах известно уже более 100 лет [1]. Причиной диспергирования металлов, в частности платины, является интеркаляция, внедрение щелочного металла в кристаллическую решетку платины и образование интерметаллического соединения, которое, затем, легко разлагается водой. И это явление было использовано для получения каталитических материалов на основе наночастиц платины [2].
Возможность интеркаляции щелочных металлов из водных растворов отмечалась в ряде работ, например интеркаляция калия в оксидно-никелевый электрод из щелочных растворов отмечена в работах Луковцева [3]; об интеркаляции натрия в никелевые вакансии гидроксо-оксида никеля сообщают также авторы [4]. Однако зафиксировать процесс интеркаляции щелочного металла и образование интерметаллического соединения весьма сложно, из-за быстрого разложения интерметаллида водой, а также газовыделения, которое сопровождает процесс диспергирования металла электрода. Поэтому в данной работе была предпринята попытка изучить процесс внедрения щелочного металла в платину из неводных и водных растворов с использованием метода импульсной хронопотенциометрии.
Процессы интеркаляции исследовали методом импульсной хронопотенциометрии с помощью трехэлектродного датчика прижимного типа с хлорсеребряным электродом сравнения (х.с.э.) в среде соответствующих растворителей (вода, ацетонитрил) и вспомогательным электродом из углеродного волокна [5]. Материал датчика – фторопласт. Диаметр сопла 0,8 мм.
Метод импульсной хронопотенциометрии заключается в анализе зависимости потенциала от времени при поляризации электрода импульсами тока постоянной или равномерно возрастающей амплитуды. Получаемая зависимость потенциала от времени представляет собой совокупность постояннотоковых хронопотенциограмм и кривых спада потенциала после отключения тока. Эти зависимости позволяют получить оценки мгновенного потенциала под током, Ej, и мгновенного бестокового потенциала (МБП) - значение потенциала в момент окончания паузы Eе. Разность этих величин представляет собой оценку мгновенной поляризации η= Eе- Ej
Получаемые импульсные хронопотенциограммы использовались для оценки интеркаляционной емкости (длина горизонтального участка зависимости E-I) и составляющих значения потенциала.
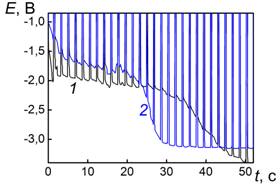
Импульсные хронопотенциограммы платины в ацетонитрильном электролите обнаруживают горизонтальный участок длины в диапазоне МБП
Ее= -0,7 – -0,8 В (х.с.э. в ацетонитриле) (рис. 1), окончание которого соответствует формированию насыщенного хемосорбционного слоя ацетонитрила на платине, в который происходит интеркаляция иона лития (рисунок 2). Существование хемосорбционного слоя ацетонитрила на поверхности платины было доказано в работе [6] на основании слабой зависимости емкости двойного электрического слоя (ДЭС) платинового электрода от потенциала в ацетонитриле в присутствии перхлората тетраэтиламмония. Представления о хемосорбции ацетонитрила подтверждают также результаты исследований монокристаллической платины в тех же электролитах методом ИК спектроскопии отражения in situ [7]. При потенциалах положительнее потенциала нулевого заряда (ПНЗ) хемосорбция осуществляется за счет неподеленной электронной пары азота, при более отрицательных потенциалах происходит изменение гибридизации и реориентация молекул в хемосорбционном слое. Авторы отмечают также накопление сольватированных катионов в ДЭС. После предварительной анодной поляризации в течение 2 часов в водном 2М NaOH при потенциале Е=3,2 В (о.в.э.) длина горизонтального участка хронопотенциограммы существенно увеличилась (кривая 2, рис. 1), что соответствует появлению дополнительных возможностей интеркаляции лития в смешанный оксидно-хемосорбционный слой.
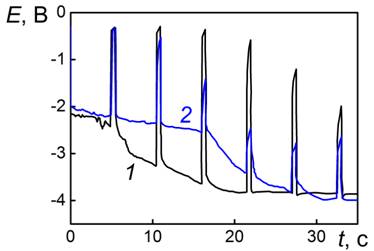
Рис. 1. Импульсные хронопотенциограммы платины в 1 М LiBF4 в ацетонитриле до (1) и после анодной поляризации в течение 2 часов в 2М водном растворе NaOH (2).
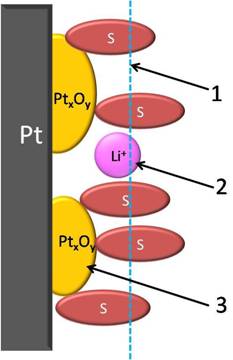
Рис. 2. Схематичное изображение поверхности платины в катодном процессе:
1 – слой хемосорбированных молекул растворителя (S); 2 – ион щелочного металла; 3 – оксиды платины
Хронопотенциограмма Pt электрода в водном растворе 2М NaOH в импульсном режиме (рис. 3) характеризуется практически неизменным МБП около Eе= -0,2 В, величина которого определяется, по-видимому, редокс-парой водорода. Поляризация Ej описывает кривую с характерным для интеркаляции горизонтальным участком при
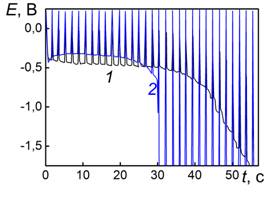
Ej= -0,7 В. Возможность интеркаляции щелочного металла в принципе подтверждается зависимостью вида катодной хронопотенциограммы от природы катиона щелочного металла. Так, в растворе LiOH, диапазон потенциалов внедрения расположен существенно выше при Ej = -0,5 В, кроме того длительность этого участка кривой больше, а значит и интеркаляционная емкость по ионам лития, больше (рис. 4а).
Интеркаляционная емкость анодно окисленной платины (2 часа при Е=3,2 В в
2М NaOH) (кривая 3, рис. 4а) выше емкости пленки PtхOуNa, где х=1-1,5; у=3-3,5, сформированной на платиновом электроде при поляризации переменным импульсным током j = 0,02 мА/см2 в 2М NaOH (кривая 2, рис. 3). По-видимому, при колебаниях потенциала в интервале Е=1,0-1,4 В на Pt в водном растворе NaOH создаются условия для образования оксидной Na-содержащей пленки, и поэтому ее емкость по щелочному металлу ниже, чем у фазового оксида, сформированного при высоких потенциалах (кривая 3, рис. 4а). МБП окисленных поверхностей лежит при более анодных потенциалах Ee=0,1-0,2 В, чем для неокисленной платины.
Таким образом, в водных растворах величина МБП на неокисленной поверхности платины определяется реакцией выделения водорода, на окисленной – восстановлением оксидной пленки. Поляризация же определяется как выделением водорода, так и параллельно протекающим внедрением щелочного металла в слой хемосорбированного растворителя.
В нейтральном электролите 1М LiBF4 катодная импульсная хронопотенциограмма (рис. 4б, кривая 1) характеризуется значительной поляризацией, что можно связать с кинетическими затруднениями интеркаляции лития из гидратированного состояния в отсутствии гидроксид-ионов. МБП для этих условий практически не изменяется и определяется, как и в щелочном электролите, водородом.
После предварительной анодной поляризации платины горизонтальный участок хронопотенциограммы перемещается к более положительным потенциалам (рис. 2 кривая 2), однако эффект предварительной анодной поляризации выражен в нейтральном электролите значительно слабее (рис. 4б), чем в ацетонитриле (рис. 1) и щелочном электролитах (рис. 4а).
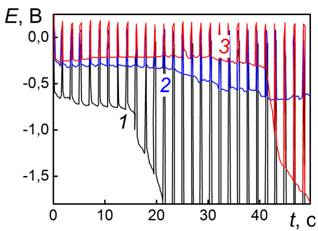
Рис. 3. Импульсные хронопотенциограммы платины в NaOH.
1- чистая платина, 2 – анодно окисленная платина (2 часа при Е=3,2В в 2М NaOH), 3- пленка PtхOуNa, где х = 1-1,5; у=3-3,5, сформированная на платиновом электроде при поляризации переменным импульсным током
j=0,02 мА/см2 в 2 М NaOH
 |
|
|
а |
б |
|
Рис. 4. Импульсные хронопотенциограммы платины |
|
Таким образом, процессы, протекающие при катодной поляризации платины как в водных (щелочных и нейтральных), так и в неводных электролитах включают электрохимическую адсорбцию молекул растворителя и интеркаляцию в адсорбционный слой ионов щелочного металла. Интеркаляция иона щелочного металла из водных растворов в адсорбционный слой активируется гидроксид-ионами, а интеркаляционная емкость адсорбционного слоя зависит от природы катиона. При наличии на платине поверхностных оксидов интеркаляция в адсорбционный слой облегчается.
Исследованиями поведения платинового электрода в ацетонитрильных и водных растворах, содержащих катионы щелочных металлов, импульсными методами была доказана возможность катодного внедрения при Е <-1,7 В щелочных металлов в платину. Показано также, что при наличии на платине хемосорбированного кислорода или фазового оксида интеркаляция облегчается и наблюдается уже при Е <-1,3 В.
Литература
- 1.Bredig G., Haber F. – Ber. Dtsch. Chem.. Ges., 1898, Bd. 31., №3 p. 2741-2752
2.Куриганова А.Б., Герасимова Е.В., Леонтьев И.Н., Смирнова Н.В., Добровольский Ю.А. // Альтернативная энергетика и экология. - 2011. - №5. - С. 58-63.
3. О.Г. Маландин, П.Д. Луковцев, Т.С. Тихонова. // Электрохимия. – 1971. - T.7, вып, 5. – C.655-662.
4.Venkat Srinivasan, John W, Weidner, Ralf E. //J, Solid State Electrochemistry, – 2000,№4 – P, 367-382.
5. Электрохимический датчик для устройства локального электрохимического экспресс-анализа//Липкин М.С., Липкин С.М., Липкина Т.В., Шишка В.Г., Боловинов Е.А. Пат. 74713 Рос. Федерации: МПК G01N 27/00. – Заявл. 06.02.2008; опубл. 10.07.2008
6. O.A. Petrii, I.G. Khomchenko // J. Electroanalytical Chemistry and Interfacial Electrochemistry. – 1980. – V.106. – P.277-286.
7.Neboja S. Marinkovi, Mathias Hecht, John S. Loring, W. Ronald Fawcett. // Electrochimica Acta. – 1996. – V.41. – P.641-651.