Нанокомпозитные органоминеральные гибридные материалы
Аннотация
Дата поступления статьи: 15.06.2014В данной статье рассмотрена природа органоминеральных гибридных нанокомпозитов. Перспективными направлениями в области органоминеральных гибридных нанокомпозиционных материалов станут методы синтеза мультикомпонентных материалов, а также типа «сетка в сетке» и «гость-хозяин». Фундаментальной проблемой химии и физики нанокомпозитов остается зависимость «структура-свойство». Решение этой проблемы позволит перейти от исследований материалов к их целенаправленному проектированию.
Ключевые слова: нанокомпозиты, золь-гель технология, синтез, наночастицы.
Введение
Композиционный материал, композит – искусственно созданный неоднородный сплошной материал, состоящий из двух или более компонентов с чёткой границей раздела между ними. В большинстве композитов (за исключением слоистых) компонен-ты можно разделить на матрицу или связующее, и включённые в неё армирующие элементы или наполнители. В композитах конструкционного назначения армирующие элементы обычно обеспечивают необходимые механические характеристики материала (прочность, жёсткость и т. д.), а матрица обеспечивает совместную работу армирующих элементов и защиту их от механических повреждений и агрессивной химической среды. Также композитами принято называть многокомпонентные системы, которые состоят из полимерной, металлической, углеродной, керамической или другой основы (матрицы), армированной наполнителями из волокон, нитевидных кристаллов, тонкодисперсных частиц и т.д. [1,2]. Использование композиционных материалов в различных инженерных приложениях стало почти искусством.
Неорганические неметаллические материалы, такие как стекло или керамику, люди получали тысячи лет, из твердых веществ, с применением высоких температур. В качестве сырья использовались природные минералы, и обработка этих материалов обычно включала измельчение твердых исходных веществ, и спекание их смеси при температурах, превышающих 700 ℃. В частности, оксидная керамика и стекло привлекают к себе внимание в последние столетия в связи с их тепловой долговечностью и химической инертностью. Их обычно получают из оксидных минералов путем смешивания с различными добавками, для получения заданных композиций. Высокие температуры, как правило, необходимы для этих твердофазных реакций, так как исходное сырье используется в виде порошков, и они вступают в реакцию в твердом состоянии или в расплавах с образованием конечного продукта. Образование продукта в твердом состоянии возможно только, если ионные компоненты диффундируют через зерна материала. Для этого им приходится преодолевать достаточно высокие силы связи в кристаллах, для чего требуется повышение температуры. Многие современные устройства электроники или оптики требуют специальных форм или применения процедур склеивания керамических деталей, и к ним недопустимо применение высокотемпературной обработки. Кроме того, для некоторых керамических изделий недоступно применение порошковой технологии, например, для тонких оксидных пленок. В связи с этим, классические твердотельные реакции имеют следующие недостатки:
• высокие температуры и длительное времени реакции, связанные с необходимостью движения ионов через твердое или формирования расплавов,
• условия реакции и качество продукции в значительной степени зависят от условий подготовки сырья (измельчение, прессование, и т.д.),
• конкретные морфологии во многих случаях недоступны с помощью классических методов (тонкие пленки, пористые материалы и т.д.),
• сочетание с органическими или биоматериалами невозможно из-за экстремальных условий изготовления.
Эти проблемы нашли свое решение с использованием композиционных материалов. Особое место в этой группе материалов занимают нано материалы и нанокомпозиты [2].
Наноматериалы — материалы, созданные с использованием наночастиц и/или посредством нанотехнологий, обладающие какими-либо уникальными свойствами, обусловленными присутствием этих частиц в материале. К наноматериалам относят объекты, один из характерных размеров которых лежит в интервале от 1 до 100 нм [3]. Выделяют два основных способа создания нанообъектов:
1. Уменьшение размера макрообъектов (диспергирование, дезинтегрирование, измельчение до кластерного уровня с помощью шаровых мельниц или при помощи механохимического синтеза);
2. Создание наноструктур из атомов и молекул (кристаллизация) кластеризация, наноструктурирование, структурообразование, конденсация коагуляция, полимеризация и т.д.
В группе наноматериалов выделяют следующие типы:
• нанопористые структуры;
• наночастицы;
• нанотрубки и нановолокна;
• нанодисперсии (коллоиды);
• наноструктурированные поверхности и пленки;
• нанокристаллы и нанокластеры;
• нанокомпозиты.
Нанокомпозит — многокомпонентный материал, состоящий из основы (матрицы) и наполнителя — наноматериала с модифицированной поверхностью и обладающего новым улучшенным комплексом свойствами. В некоторых случаях может наблюдаться инверсия наноразмерности у связующего и наполнителя.
Сами наноматериалы делят по назначению на функциональные, композиционные и конструкционные.
По количеству измерений они делятся на:
• нульмерные/ квазинульмерные (квантовые точки, сфероидные наночастицы);
• одномерные/ квазиодномерные (квантовые проводники, нанотрубки);
• двумерные/квазидвумерные (тонкие пленки, поверхности разделов);
• трехмерные/квазитрехмерные (многослойные структуры с наноразмерными дислокациями, сверхрешетки, нанокластеры, нанокомпозиты, супрамолекулярные образования).
Свойства наноматериалов, как правило, отличаются от аналогичных материалов в массивном состоянии. Например, у наноматериалов можно наблюдать изменение оптических, магнитных, тепло- и электропроводных свойств. Для особо мелких материалов можно заметить изменение температуры плавления в сторону её уменьшения.
В настоящем обзоре мы остановимся на отдельной группе нанокомпозитов – органоминеральных гибридных композиционных материалах. На практике нанокомпозиционные материалы, содержат усиливающие элементы с чрезвычайно высокой удельной поверхностью, погруженные, например, в полимерную матрицу. В этом случае органическая и неорганическая составляющие формируют независимые фазовые образования, поэтому контакт осуществляется на уровне раздела фаз [4].
Перспективными современными композитными материалами являются такие, в которых органическая и неорганическая составляющие взаимодействуют между собой на молекулярном уровне. Они получили название «полимерные гибриды» [5,6]; понятие «гибрид» было принято для того, чтобы подчеркнуть, молекулярный характер взаимодействия компонентов.
Гибридные материалы – материалы, полученные за счёт взаимодействия химически различных компонентов, чаще всего органических и неорганических, формирующих определенную пространственную структуру, отличающуюся от структур исходных реагентов, но часто наследующую определенные мотивы и функции исходных структур.
Особенностью новых композитных материалов является то, что они имеют нанометровые параметры своих структурных элементов (размер хотя бы в одном из направлений составляет не более 100 нм); это либо нанометровые расстояния между решетками и слоями, которые образованы полимерными и неорганическими ингредиентами, либо нанометровые размеры формирующихся частиц, в том числе и металлсодержащих [7].
В качестве неорганических соединений – предшественников (прекурсоров) – обычно используют оксиды кремния, алюминия, титана, циркония, ванадия, молибдена, глины, слоистые силикаты и цеолиты, фосфаты и халькогениды металлов, оксихлорид железа, графит, различные металлы и т.д.. В качестве полимерной составляющей применяют не только карбоцепные, но и элементоорганические, как правило, кремнийорганические полимеры.
С экологической точки зрения оптимальными являются бессточные способы получения композитных материалов, в частности, золь-гель технология (sol-gel или spin-on-glass process). Этот способ позволяет исключить многочисленные стадии промывки, так как в качестве исходных веществ используют соединения, не вносящие примеси в состав конечного продукта [8].
Золь – это коллоидная дисперсия твердых частиц в жидкости. Коллоиды – это суспензии, в которых дисперсная фаза настолько мала (1…1000 нм), что гравитационными силами можно пренебречь. Доминирующими являются короткодействующие силы, такие как ван-дер-ваальсовы, а также кулоновские силы, притяжение и отталкивание между поверхностными зарядами. Инерция дисперсной фазы мала, поэтому возникает броуновское движение частиц (броуновская диффузия), т. е. случайные скачки, вызываемые кинетической энергией, сообщаемой за счет столкновений частиц золя между собой и с молекулами дисперсионной среды. Важным фактором служит то, что частицы дисперсной фазы являются не молекулами, а агрегатами, состоящими из множества молекул [10].
Образование коллоидного геля происходит по другому принципу. Частицы дисперсной фазы (мицеллы) под воздействием дисперсионных сил притяжения взаимодействуют друг с другом, образуя остов неорганического полимера.
Гель из полимерного золя образуется в процессе полимеризации мономеров и полимеров, находящихся в золе. Постепенно из полимеризующихся разветвленных олигомеров образуется гигантский кластер. Когда этот кластер достигнет макроскопических размеров и распространится на весь объем золя, говорят, что произошел переход золя в гель. При этом гель будет состоять, с одной стороны, из непрерывной структурной сетки – твердого скелета (остова), а с другой – из непрерывной жидкой фазы.
Образование коллоидного геля происходит по другому механизму. Частицы дисперсной фазы (мицеллы) под воздействием дисперсионных сил притяжения взаимодействуют друг с другом, образуя остов неорганического полимера. Гель состоит из непрерывных твердой и жидкой фаз, которые имеют коллоидные размеры (от 1 до 1000 нм). Эти фазы являются непрерывными взаимопроникающими системами.
1. ЗОЛЬ-ГЕЛЬ ТЕХНОЛОГИЯ
Наиболее изученные системы в золь-гель химии, безусловно, системы на основе кремния, которые также явились исторический началом химии золь-гель процессов [21]. Впервые еще в 1845 году Ebelmen получил прозрачный материал путем медленного гидролиза сложного эфира кремниевой кислоты. При этом образование геля кремниевой кислоты при подкислении силикатов щелочных металлов было известно ученым химикам еще раньше, но практического значения этому процессу никто не придавал. На первых этапах исследований золь-гель процесса, из чистого диоксида кремния в основном, формировались керамика. Однако вскоре стало ясно, что процесс может использоваться также для формирования оксидов других металлов [22]. Кроме того, было показано, что смешение нескольких исходных веществ позволяет получать материалы более сложного состава. Однако в подобных сложных системах, для достижения однородности материала, необходимо знать свойства и поведение каждого индивидуального компонента в условиях осуществления синтеза.
По отношению к другим методам синтеза неорганических оксидных материалов, в том числе и наночастиц [9,10], золь-гель процессы обладают рядом существенных преимуществ [7], к ним, в частности, относятся:
• возможность создания уникальной структуры с ультрадисперсной фазой; возможность вести контролировать поверхность материала на ранней стадии его получения;
• обеспечение высокой чистоты, как исходного материала, так и получаемого продукта (особенно в случае использования алкоксидов);
• гомогенность распределения компонентов, в том числе и небольших модифицирующих добавок;
• возможность достижения однородности образующихся соединений, вплоть до молекулярного и ионного уровней;
• возможность получения новых кристаллических и аморфных фаз, материалов с катионами в несвойственных им степенях окисления, синтез которых традиционными методами затруднителен либо невозможен;
• регулирование реологических свойств золей и дисперсий наночастиц, что позволяет получать широкий спектр изделий от покрытий до монолитов.
Как правило, для реализации золь-гель процессов используют два традиционных подхода [10], которые, однако, имеют ряд ответвлений:
• коллоидный метод – гелеобразование гидрозолей, происходящее благодаря ассоциации частиц водной суспензии (например, через водородные связи между группами, принадлежащими разным частицам). Разновидностью данного метода является прямое осаждение и полимеризация гидратированных оксидов химических элементов из растворов их солей, например, из растворимых силикатов;
• алкоксидный метод – гидролитическая поликонденсация исходных соединений (алкоксидов, нитратов и т.д.) в водно-органических средах, с последующим высушиванием продуктов, либо в атмосферных, либо в сверхкритических условиях. В последние годы стали использовать – негидролитический метод. Это альтернативный путь заключается во взаимодействии галогенида металла с донорами кислорода - алкоксидами металлов, в безводной среде.
1.1. Алкоксидный метод золь-гель синтеза
Существуют альтернативные схемы реакций при формировании оксидных материалов путем осаждения [11], гидротермальной обработкой [12,13] или использование золь-гель процесса [14,15]. Золь-гель процесс является наиболее интересным процессом, в связи с высоко технологичностью применений в таких современных областях, как тонкие пленки в электронных или оптических приборах [16-19]. Она начинается с молекулярной прекурсоров, и формирование оксидной сетки происходит при довольно низких температурах [20]. В отличие от классических твердофазных реакций, формирование материала обычно проводят в растворе. Таким образом, активные формы реагентов рассредоточены на молекулярном уровне, который обеспечивает малую длину диффузии реагирующих веществ и, таким образом, высокую скорость реакций при умеренных условиях. Кроме того, молекулярные предшественники показывают то преимущество, что они могут быть очищены обычными способами, такими как ректификация и хроматография, и, следовательно, для формирования материалов доступны очень чистые исходные вещества, что очень важно в прикладных областях, таких как электроника, оптика, или биомедицинские устройства.
Одной из основ нанотехнологии является то, что первичный размер исходных структурных элементов, образующихся в золь-гель процесса, находится в диапазоне нанометрового размера. Есть несколько технологий, где золь-гель процесс является самым передовым уровнем техники, например, износостойкие или просветляющие покрытия [23,24]. В настоящее время, этот процесс широко используется в производстве наночастиц [25,26].
Золь-гель процесс обеспечивает управление структурой в различных масштабах длины и, таким образом позволяет формировать иерархически структурированные материалы [27]. Преимущества золь-гель процесса по отношению к производству нанокомпозитных материалов, заключаются в возможности контроля над механизмом и кинетикой существующих реакционных стадий. Это позволяет иметь возможности формирования иерархических материалов, например, управлять свойствами материалов начиная от макроскопического и заканчивая молекулярным уровнем. Кроме того, благодаря мягким условиям этого процесса, можно осуществлять такие модификации материалов, которые невозможны в случае классического высокотемпературного керамического синтеза. Например, благодаря низкой температуре и наличию растворителей, можно включать в структуру материала органические или биологические группы и компоненты. Это дает возможность осуществлять формирование органо-минеральных гибридных материалов или нанокомпозитов, которые демонстрируют свойства, полностью отличающиеся от традиционных материалов [28].
Таким образом, золь-гель процесс больше подобен процессу полимеризации, приводящему к образованию трехмерной керамической структуры, как в случае образования полимерной сети. Этим он отличается от классического высокотемпературного неорганического твердофазного процесса. Из-за этого сходства, процесс золь-гель идеально подходит для формирования нанокомпозитов, которые содержат как неорганические, так и органические полимерные структуры.
Золь-гель процесс является химической реакцией, которая начинается от иона или молекулярного соединения и позволяет образовать трехмерную полимерную сеть через образование мостиковых оксо-связей между ионами (рис. 1) и освобождение воды или других небольших молекул. Таким образом, процесс является реакцией поликонденсации, которая приводит к трехмерной полимерной сети.
Гидролиз:
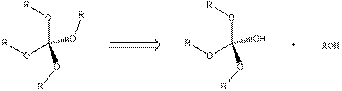
Конденсация:
Или:
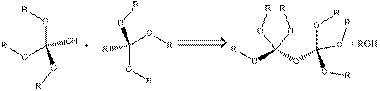
Рис. 1. Основные химические реакции, протекающие при золь-гель процессе в водном растворе.
При протекании золь-гель процесса в водном растворе, особым видом радикала является образующаяся на первом этапе M-OH связь, которая не является стабильной и вступает в реакцию с другими видами радикалов. Эта первая стадия является гидролизом. На второй стадии, лабильная группа М-ОН конденсируется с другими М-ОН или M-OR (если исходными продуктами в золь-гель процессе были алкоксиды используемых элементов) группами с образованием M-O-M связи и выделением воды или спирта. Таким образом, формируется трехмерная решетка. Как правило, полученные промежуточные продукты не полностью конденсируют в этом процессе вследствие стерических и кинетических затруднений. Они включают в свою структуру воду или ОН-группы. Поэтому получаемые продукты правильнее отнести к классу гидратированных оксидов [29,30].
Протекание процессов гидролиза и конденсация приводят сначала к образованию твердых частиц, которые взвешены в жидкости, к так называемому золю. Частицы на этапах конденсации содержат на своей поверхности активные группы и, поэтому, они сшиваются в гель. Гель формируется в виде твердой ажурной сети или каркаса, которые содержат в своих порах жидкость.
Как правило, гидролиз алкоксидов кремния является довольно медленным процессом. Таким образом, как правило, для ускорения золь-гель процесса применяются как катализаторы кислоты или основания. Катализаторы оказывают существенное влияние на конечную структуру образующейся сети. Кроме того, существует также различная реакционная способность у не сконденсировавшихся и частично сконденсировавшихся промежуточных частиц кремниевой кислоты, что приводит к образованию различных силикатных структур. Стадия формирования сети носит статистический характер. В результате этого формируются силикатные структуры, которые лучше всего описываются с помощью фрактальной геометрии.
Как правило, кислоты как катализаторы, приводят к расширенной структуре, подобной полимерам, в то время как основания приводят к структуре, состоящей из отдельных связанных между собой частиц.
В случае гелей на основе алкоксисиланов, размер, структура и сшивка образованных полимерных сетей, зависят от соотношения SiOR в SiOH, и скоростей гидролиза и конденсации. В золь-гель процессе, катализируемом кислотой, на первой стадии происходит быстрое протонирование алкоксидной группы. Данная реакция является реакцией нуклеофильного замещения. В ней атаку осуществляет нуклеофил — реагент, несущий неподеленную электронную пару. Алкоксидная группа замещается водой по схеме реакции SN2. Механизм реакции SN2 или реакции бимолекулярного нуклеофильного замещения происходит в одну стадию, без промежуточного образования интермедиата. При этом атака нуклеофила и отщепление уходящей группы происходит одновременно. Скорость реакции SN2 зависит как от концентрации нуклеофила, так и концентрации субстрата [31]:
ra = ka × [Si(OR)4] × [H3O+]
rb = kb × [Si(OR)4] × [OH-]
Так как в процессе реакции атака нуклеофилом, ионом гидроксония H3O+ или OH- ионом, может происходить только с одной стороны, результатом реакции является стереохимическая инверсия образующегося продукта. Это явление может оказаться полезным при получении биологически активных нанокомпозитов с использованием методов асимметрического синтеза.
Эта, катализируемая кислотой реакция, более вероятно протекает на концах обра-зующихся олигомеров, с предпочтительным образованием линейных полимеров (рис. 2).
Кислотный катализ:
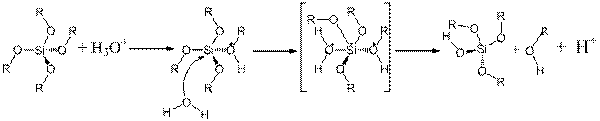
Основной катализ:
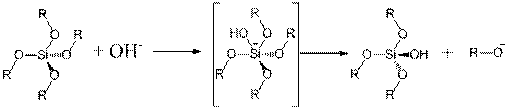
Рис. 2 Механизм формирования силанольных групп в зависимости от используемого катализатора
В щелочной среде, поликонденсации происходит гораздо быстрее, и реактивность возрастает с уменьшением числа алкоксигрупп, связанных с атомом кремния. Механизм в этом случае основан на взаимодействии нуклеофильного гидроксильного аниона с атомом кремния алкоксисилана. Реакция гидролиза происходит через образование отрицательно заряженного промежуточного продукта с координационным числом 5. Конденсация из силанольных групп предпочтительно происходит не на концах цепи, а на внутренних центрах олигомеров, что приводит к сильно разветвленным плотным структурам. Таким образом, образуются небольшие сферические частицы.
Обычно, в качестве катализатора применяются простые минеральные кислоты или гидроксиды металлов, но также могут быть использованы и фторид ионы F-.
Переход золь-гель зависит от концентрации исходного реагента, воды, катализатора, температуры и рН. Конечный твердый материал имеет множество поверхностных ОН-групп, которые могут быть стабилизированы водородными связями с растворителем и остаточной водой. Кроме того, после гелеобразования, в материале присутствуют еще много остаточных алкоксидных групп и не сконденсировавшихся ОН-групп. На стадии старения, эти группы реагируют друг с другом с образованием дополнительного количества воды и спиртов. Кроме того, в процессе старения происходит перенос вещества частиц геля из внешней зоны, в зону контакта частиц между собой, и таким образом происходит укрупнение частиц, сформировавших гель. Таким образом, время старения оказывает большое влияние на текстурные свойства материала. Дальнейшие стадии конденсации приводят к уплотнению материала и сжатию геля. Старение может быть ускорено путем повышения температуры. Но это может привести к образованию трещин в чистых гелях.
Для последующих применений, гель должен быть высушен. Удаление жидкости из геля означает резкое сжатие структуры геля, в результате чего изделие, получает сильную усадку по сравнению с первоначальной формой. Усадка может составлять до 50-70% от исходного размера. Для получения нанокомпозита летучие компоненты должны быть удалены из конечного материала перед его применением в соответствующих изделиях.
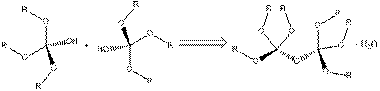
Как правило, в качестве исходного сырья для осуществления золь-гель процесса используются алкоксиды соответствующих химических элементов. В случае кремния, наиболее известны следующие алкоксиды: тетраметоксисилан Si(OCH3)4 (TMOS) и тетраэтоксисилан Si(OCH2CH3)4 (ТЭОС). Скорость гидролиза TMOS значительно выше по сравнению с ТЭОС, в то же время в результате реакции образуется метанол, который не всегда является допустимым спиртом в золь-гель реакции, из-за его токсичности. Оба вещества являются жидкими при стандартных условиях и могут быть очищены методом ректификации. Как правило, модель замещения и, следовательно, органические остатки в предшественниках оказывают большое влияние на кинетику золь-гель процесса. Как было показано выше, применение TMOS или ТЭОС в качестве предшественников в золь-гель процесса при средней термообработке приводит к трехмерной решетке кремнезема. Однако золь-гель процесс хорошо известен для производства гибридных материалов, включающих в себя органические функциональные группы, которые прикреплены к неорганической решетке. Для этого требуются различные исходные вещества, которые содержат Si-OR группы и могут быть гидролизованы, а также Si-C связи, которые стабильны к гидролизу. Результатом применения таких промежуточных соединений при золь-гель реакции, является введение органической группы в конечный материал. Применение этой методологии позволяет легко встраивать органические функциональные группы в образовавшуюся неорганическую решетку. В результате появляется конечный материал, который может нести определенные органические функциональные группы. Эти группы могут придавать материалу определенные оптические или электронные свойства, а также изменять химическую реакционную способность и полярность кремнеземной решетки. Формирование решетки возможно только в том случае, если используемый прекурсор имеет, по крайней мере, три возможных места для сшивки. Оба, тетраалкоксисиланы Si(OR)4 и триалкоксисиланы (RO)3SiR0, обладают этой способностью (рис. 3). Другие алкоксиды типа (RO)2SiR02 или (RO)SiR03 также могут реагировать путем гидролиза и конденсации, но бис-алкоксиды могут образовывать только цепочечные молекулы, а моно-алкоксиды образуют только димеры. Если они используются в обычном золь-гель процессе, они могут модифицировать неорганической решетку. Например, если присоединить моно алкоксисилан к поверхности кремнеземной решетки, то появится определенное количество функциональных групп, присоединенных к поверхности неорганической субстанции. Хотя моно алкоксисиланы не используются в обычном золь-гель процессе, они могут быть использованы для модификации поверхности, неорганического компонента за счет поверхностных реакций.
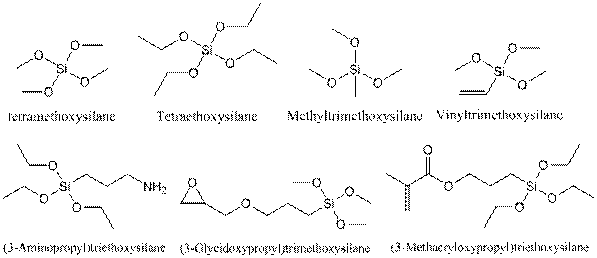
Рис. 3. Выбор часто используемых алкоксисилановых соединений
Молекулы, которые содержат более одной алкоксиднокремниевой группы, например, системы, содержащие две или более алкоксигруппы (триалкоксид (RO)3Si-R0-Si(OR)3), также используются в золь-гель процессах [34]. Эти исходные вещества позволяют включать органическую функциональную группу непосредственно в решетку твердого материала, а это значит, что органические функциональные группы являются частью решетки, в то время как молекулы типа (RO)3SiR0 присоединяют функциональную группу R0 к сети (рис. 4).

Рис. 4. Разница между органосиланами типа (RO)3Si-R0 и (RO)3Si-R0-Si(OR)3), в реакции образования силоксаново-органической сети.
С одной стороны, смесь тетра-алкоксисиланов и три-алкоксисиланов используют в золь-гель процессах, для получения плотной кремнеземной решетки, путем гидролиза и конденсации тетра-алкоксидов. С другой стороны присутствие в реакционной смеси три-алкоксисиланов используют для включения в структуру органических функциональных и образования гибридных материалов.
Важным параметром оптимизации золь-гель процесса, являются: соотношения различных компонентов, например, отношение воды к алкоксиду С = H2O/M(OR)n; ис-пользование катализаторов; а также природа алкоксидного предшественника. В зависимости от типа алкоксигруппы, кинетика процесса может значительно меняться [32].
Материалы на основе кремния, полученные с помощью золь-гель процесса, часто бывают пористыми, в связи с тем, что конечный материал представляет собой гель. В его порах находится растворитель, например, вода и спирт, образованный из исходного алкоксида кремния. Кроме того, образование геля при гелировании золя не означает, что реакции гидролиза и конденсации остановлены в реакционном сосуде. Точка гелеобразования только определяет момент времени, когда происходит резкое увеличение вязкости, из-за трехмерной сшивки частиц золя. Поэтому, как правило, полученные материалы старятся в течение некоторого времени при комнатной или повышенной температуре. Во время старения, происходит дальнейшее уплотнение материала, обусловленное продолжающимися реакциями гидролиза и конденсации, в результате чего, гель дает усадку. Удаление растворителя из немодифицированного геля, например, путем его испарения при повышенной температуре, обычно приводит к разрушению структуры геля и заканчивается образованием порошка. Причиной этого являются высокие капиллярные силы, возникающие в процессе испарения, которые разрушают филигранную сеть геля. Для ликвидации или уменьшения этого явления жидкость в порах геля может быть заменена на растворитель, который обеспечивает низкие капиллярные силы. Одним из таких процессов является обмен растворителя в составе геля, на вещество, которое находится в его сверхкритическом состоянии и, таким образом, может быть введено в материал непосредственно в газовой фазе. Этот прием называется сушкой в закритической области. Применение этого метода приводит к сохранению структуры геля. Полученные таким образом легкие материалы называются аэрогели. В дополнение к упомянутой морфологии сетки геля, в зависимости от условий обработки, также могут быть получены различные частицы, волокна и тонкие пленки.
Если тетра-алкоксисиланы являются единственными предшественниками, используемыми при формировании структуры оксида кремния, то получаемые материалы имеют гидрофильную поверхность. Таким образом, во многих случаях, материалы могут активно взаимодействовать с водой и атмосферной влагой. Особенно это характерно для случая, когда материалы имеют высокую пористость, например, аэрогели [35]. Гидрофильные свойства поверхности могут быть изменены, если силанольные группы на поверхности заменены органическими гидрофобными группами. Этот процесс может происходить как после получения материала, так и в процессе его получения. В последнем случае это возможно, если материал получается соконденсацией, в присутствии второго органического функционального вещества.
Возможность придать структуре геля определенные функциональные свойства, пользуясь различными путями, также является важным шагом в формировании нанокомпозитов. Это обусловлено тем, что в этих материалах межфазное взаимодействие между неорганической и органической составляющими играет важную роль при определении, какой образуется материал - гомогенный или гетерогенный.
1.2. Негидролитический метод золь-гель синтеза
Другим направлением получения органо-минеральных гибридных материалов является негидролитический способ. Он строится либо на негидролитической реакций гидроксилирования или на апротонных реакциях конденсации (рис. 5) [4,33]. В конкретном случае, этот метод основан на реакции галоида металла (MX) с донорами кислорода (такими как алкоксид металла, простой эфир, спирт и т.д.) в безводной среде. В качестве побочного соединения этой реакции образуется алкилгалоидное соединение.
Во многих случаях для осуществления этих реакций требуются более высокие температуры. Поэтому, применимость этого процесса к органическим группам, ограничена. Реакции негидролитического или неводного золь-гель процесса недавно было уделено большое внимание, потому что он представляет собой метод для создания высоко окристаллизованных наночастиц [26].
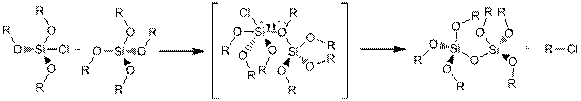
Рис. 5. Пример одного из механизмов для реакции негидролитического золь-гель процесса получения неорганических оксидов
При подготовке нанокомпозитов этот метод редко используется в связи с температурными ограничениями и, следовательно, доступен только для определенных типов полимеров.
Однако этот метод имеет ряд преимуществ:
• отсутствие растворителей;
• уменьшение или исключение образования силанольных групп в конечном продукте вследствие иного механизма реакции по сравнению с гидролитическим методом золь-гель синтеза;
• легче добиться однородности смеси исходных веществ, особенно для неполярных молекул.
Одновременно с этим следует иметь в виду, что:
• необходимо проявлять повышенную осторожность при работе с некоторыми высокореакционными реагентами, которые используются в негидролитическом методе;
• взаимодействие кислородсодержащих молекул может быть осложнено их участием в реакциях в качестве донора кислорода.
Негидролитический метод был предметом исследования ряда работ [38-44] для выявления его преимуществ с целью получения неорганических оксидов. Однако, он крайне мало используется для синтеза органо-минеральных гибридов. Еще в 1955 году Андриановым К.А., в его классической монографии, был описан синтез некоторых алкил- и арил- модифицированных силикатов (и линейных полиорганосилоксанов) посредством различного комбинирования диметилдихлорсилана, метилфенилдихлор-силана, фенилтрихлорсилана, фенилтриэтоксисилана и фенилэтилдиэтоксисилана в присутствии хлорида железа (III) или хлорида алюминия (III), при Т=95÷100 ![]() . Проверка полученных результатов показала, что эти реакции протекают по механизму гетерофункциональной ступенчатой поликонденсации с образованием нерастворимого, разветвленного органо-модифицированного силиката, когда в качестве кремний-содержащего прекурсора использовались ди- и три - функциональные алкоксисиланы. Но никаких дополнительных исследований полученных образцов не было проведено.
. Проверка полученных результатов показала, что эти реакции протекают по механизму гетерофункциональной ступенчатой поликонденсации с образованием нерастворимого, разветвленного органо-модифицированного силиката, когда в качестве кремний-содержащего прекурсора использовались ди- и три - функциональные алкоксисиланы. Но никаких дополнительных исследований полученных образцов не было проведено.
Негидролитический метод золь-гель синтеза изучали при формировании органо-модифицированных силикатов (называемых ORMOSILs) с различными органическими группами [45]. Для формирования кремнеземной решетки были использованы моно - и ди- замещенные алкокси прекурсоры с алкильными группами различной длины: от –СН3 до –С10Н21. Хотя аналогичные гибриды могут быть получены и гидролитическим методом, все же негидролитический подход имеет некоторые преимущества, особенно при синтезе гидрофобных гибридов. Например, существует ограничение на введение соединения содержащего – С8Н17 группы в процессе синтеза гибрида гидролитическим путем, так как при увеличении их концентрации в системе наблюдается фазовое разделение смеси [46]. Таких проблем не возникает в процессе негидролитического синтеза кремнийсодержащих соединений, имеющих в качестве заместителей даже – С10Н21 группы. Единственным ограничением взаимодействия таких объемных заместителей является стерический эффект, который может оказывать влияние на скорость реакции конденсации и общую степень конденсации.
Например, гибриды состава SiO2–полидиметилсилоксан могут быть получены как гидролитическим, так и негидролитическим золь-гель способом. Используя гидролитический метод золь-гель синтеза можно получать материалы [47], характеризующиеся различной твердостью в зависимости от соотношения прекурсоров, начиная с твердых и до резиноподобных [48]. При помощи негидролитического способа можно синтезировать гибридные материалы на основе кремнийсодержащего соединения и полидиметилсилоксана, используя в качестве катализатора хлорид железа (III). При этом продукты реакции не обладают эластическими свойствами даже при 50% содержании силоксана.
1.3. Коллоидный метод золь–гель синтеза
Первый шаг в подготовке нанокомпозитов из кремнезема, представляет собой золь-гель процесс получения геля. Коллоидный метод золь–гель синтеза включает в себя как совместное связывание коллоидных частиц, так и формирование трехмерных сеток. Преимущества коллоидного метода по сравнению с алкоксидным заключаются в следующем:
• использование готовых агрегативно устойчивых золей поликремниевой кислоты с разными размерами частиц от 5 до 100 нм;
• низкая стоимость кремнийсодержащего прекурсора;
• возможность использования различных модифицирующих агентов, способствующих изменению адгезионных, прочностных, электрических и других свойств получаемого материала.
Термин «коллоидный кремнезем» относится к стабильным дисперсиям, состоящим из дискретных частиц аморфного кремнезема (SiO2). Его обычно считают гидрофильным золем, поскольку частицы стабилизируются посредством «сольватации» или «гидратации». Такое определение исключает растворы поликремниевых кислот, в которых полимерные молекулы или частицы настолько малы, что оказываются нестабильными. В водном растворе кремнезем при t=25 ![]() и рН 7 существует в виде Si(OH)4 и его растворимость составляет примерно 0,001 мас. %. При рН2 она увеличивается в 1,5 раза, а при рН 10 – почти в 10 раз [49]. Когда концентрация мономера в растворе превышает значение, соответствующее равновесной растворимости, а твердая фаза, на которой мог бы осаждаться растворимый кремнезем, отсутствует, имеет место полимеризация мономера путем поликонденсации [50]. В результате поликонденсации низкомолекулярных кремниевых кислот образуется зародышевый золь и происходит рост его частиц. Никакой агрегации частиц нет, если концентрация электролита составляет менее 0,1-0,2 N в зависимости от концентрации кремнезема. В золях кремнезема свободная энергия поверхности раздела аморфный кремнезем-вода равна 50 эрг/см2 [50].
и рН 7 существует в виде Si(OH)4 и его растворимость составляет примерно 0,001 мас. %. При рН2 она увеличивается в 1,5 раза, а при рН 10 – почти в 10 раз [49]. Когда концентрация мономера в растворе превышает значение, соответствующее равновесной растворимости, а твердая фаза, на которой мог бы осаждаться растворимый кремнезем, отсутствует, имеет место полимеризация мономера путем поликонденсации [50]. В результате поликонденсации низкомолекулярных кремниевых кислот образуется зародышевый золь и происходит рост его частиц. Никакой агрегации частиц нет, если концентрация электролита составляет менее 0,1-0,2 N в зависимости от концентрации кремнезема. В золях кремнезема свободная энергия поверхности раздела аморфный кремнезем-вода равна 50 эрг/см2 [50].
Силикагели синтезируют из молекулярных кремнийсодержащих предшествующих соединений. Два общих метода используются для инициирования гелеобразования раствора жидкого стекла:
1. Подкисление или частичная нейтрализация раствора силиката натрия при добавлении кислоты Бренстеда.
2. Замена ионов натрия Na+ на протоны H+ с помощью ионообменной смолы в кис-лотной форме, формируя, таким образом, раствор кремниевой кислоты и инициируя ге-леобразование путем добавления основания Льюиса (F-) или основания Бренстеда (OH-).
Способ (1) представляет собой так называемый процесс одного этапа. Доведение рН до величины между 5 и 9 эквивалентно частичной нейтрализации силиката натрия. Как правило, для описания этого процесса используется термин кислотный катализ. Строго говоря, это верно лишь отчасти, потому что добавление кислоты служит основной цели, частичной нейтрализации щелочного раствора силиката натрия и снижению рН. Метод (2) является классическим двухэтапным процессом. Чтобы описать различные стадии получения золя и образования геля, тот же язык часто встречается в литературе для системы жидкого стекла. В дальнейшем, давайте обсудим образование силикагеля из жидкого стекла. Двумя ключевыми этапами в этом процессе являются нейтрализация и конденсации. Рисунок 6 показывает нейтрализацию силиката с обрпзованием кремниевой кислотой H2SiO3. На втором этапе, соответственно, показано формирование димерных частиц с одним эквивалентом кремниевой кислоты (А) или силиката натрия (B).
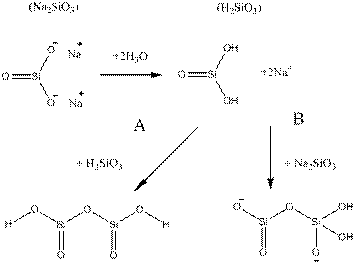
Рисунок 6. Подкисление молекулы силиката натрия с получением кремниевой кислоты и реакции с другой молекулой (А) кремниевой кислоты или (B) силиката натрия [76].
Основная стадия в процессе образования геля – столкновение двух кремнеземных частиц, обладающих достаточно низким зарядом поверхности. Когда частицы вступают во взаимный контакт, между ними образуются силоксановые связи, необратимо удерживающие частицы вместе. Для формирования подобной связи необходимо либо каталитическое действие гидроксил-ионов, либо дегидратация поверхности частиц при более высоких значениях рН. Это доказывается тем фактом, что скорость образования геля в области рН 3-5 возрастает с повышением значения рН и пропорциональна концентрации гидроксил-ионов. При рН < 6 недостаток гидроксил-ионов уже не является фактором, ограничивающим скорость гелеобразования. Однако скорость агрегации понижается из-за более редкого числа столкновений между частицами вследствие возросшей величины заряда на их поверхности. Суммарным результатом одновременного действия этих двух эффектов оказывается наибольшая скорость гелеобразования при рН 5. Как только между частицами образуются силоксановые связи, происходит дальнейшее осаждение кремнезема в точке контакта благодаря отрицательному радиусу кривизны [51]. Такой процесс идет быстро выше рН 5 и медленно при рН 1,5. Скорость гелеобразования, по-видимому, пропорциональна суммарной площади поверхности кремнезема, имеющегося в данном объеме золя, и возрастает с повышением температуры. Существенные данные, относящиеся к энергии активации процесса агрегации частиц, могут быть получены только в том случае, когда частицы уже закончили свой рост и стабилизированы при более высокой температуре, чем предусматривалось в проводимых экспериментах. Ниже рН 3,5 присутствие солей слабо влияет на скорость гелеобразования, тогда как смешиваемые с водой органические жидкости, подобные спирту, замедляют этот процесс.
Когда золь превращается в гель, сначала повышается вязкость системы, поскольку связанные вместе частицы образуют разветвленные цепочки, которые целиком заполняют объем, а затем происходит его затвердевание. Такая сетка благодаря капиллярному строению может удерживать жидкость.
1.4. Растворимые силикаты, как прекурсоры в золь-гель технологии получения нанокомпозитов
Растворимые силикаты натрия и калия (растворимые стекла) представляют собой вещества в аморфном стеклообразном состоянии, характеризующиеся определенным содержанием оксидов – М2О и SiO2, где М – это Na и К. Мольное соотношение SiO2/M2O составляет 2,6÷3,5 при содержании SiO2 69÷76 масс. % для натриевого стекла и 65÷69 масс. % – для калиевого.
Жидкое стекло принято подразделять по виду щелочного катиона на натриевые, калиевые, литиевые, органических оснований. По массовому или мольному соотношению в стекле: SiO2 и М2O, где М – это К, Na, Li или органическое основание. При этом мольное соотношение SiO2/M2O называют силикатным модулем жидкого стекла п. Вторичной характеристикой жидкого стекла является содержание в нем SiO2 и М2O в масс.%; содержание примесных компонентов А12O3, Fe2O3, CaO, MgO, SO42- и др., и его плотность (г/см3). Химический состав жидких стекол характеризуют по содержанию кремнезема и других оксидов, независимо от конкретной формы их существования в растворе. В некоторых странах в характеристику жидких стекол включают также значение вязкости растворов.
Натриевые жидкие стекла обычно выпускают в пределах значений силикатного модуля от 2,0 до 3,5 при плотности растворов от 1,3 до 1,6 г/см3. Калиевые жидкие стекла характеризуются значениями силикатного модуля 2,8-4,0 при плотности 1,25-1,40 г/см3[52-55].
Кислотостойкие строительные материалы на основе жидкого стекла находят широкое применение в строительстве в качестве силикатных полимербетонов, замазок, шпатлевок и т.п. Растворимые силикаты натрия (жидкие стекла) используются как свя-зующие компоненты для изготовления жаропрочных, химически стойких материалов. Жидкие стекла обладают высокой когезионной прочностью, легки и безопасны, имеют низкую стоимость, не подвергаются коррозии, не испаряют пожароопасных летучих компонентов и не ухудшают окружающую среду в процессе эксплуатации.
В последние годы получило интенсивное развитие направление в технологии керамики и неорганических композитов – формование материалов из растворов с использованием золь-гель процессов. Естественно, в первом ряду таких материалов стоят продукты на основе кремнезолей, который, в данном случае, являются продолжением ряда жидких стекол, при устремлении силикатного модуля к бесконечности [56].
Практическое использование жидких стекол осуществляется по следующим направлениям. Первое направление связано с проявлением жидким стеклом вяжущих свойств – способности к самопроизвольному отвердеванию с образованием искусственного силикатного камня. Уникальной способностью жидкого стекла являются также его высокие адгезионные свойства к подложкам различной химической природы. В этих случаях жидкое стекло выступает в качестве химической связки для склеивания различных материалов, изготовления покрытий и производства композиционных материалов широкого применения.
Второе направление предусматривает применение жидких стекол в качестве источника растворимого кремнезема, т.е. исходного сырьевого компонента для синтеза различных кремнеземсодержащих веществ – силикагеля, белой сажи, цеолитов, катализаторов и носителей для них, кремнезоля и др.
Третья область относится к применению силикатов щелочных металлов в качестве химических компонентов в составе различных веществ. Это направление предусматривает использование жидкого стекла в производстве синтетических моющих средств, для отбелки и окраски тканей, при производстве бумаги и т.д.
Жидкие стекла – растворы щелочных силикатов натрия и калия являются пред-ставителями более обширного класса водо-растворимых силикатов и жидких стекол, выпускаемых в промышленных масштабах. К водорастворимым силикатам относятся кристаллические безводные силикаты натрия и калия, кристаллические и аморфные гид-росиликаты натрия и калия в виде порошков и др.. Аморфные порошки гидросиликатов щелочных металлов [57], характеризуются составами в пределах SiO2/M2O=2÷3,5 при содержании связанной воды 15÷20%. Такие порошки получают, как правило, распылительной сушкой концентрированных жидких стекол и высокотемпературной гидратацией стекловидных силикатов. Они сыпучи, быстро растворяются в холодной и горячей воде. Кристаллические гидросиликаты промышленного производства обычно представлены кристаллогидратами двузамещенного ортосиликата натрия Na2H2SiO4, содержащим от 4 до 9 молекул кристаллогидратной воды. Этот гидросиликат называют также метасиликатом с формулами Na2O·SiO2·5H2O и Na2O·SiO2·9H2O.
Перечисленные выше продукты – жидкие стекла, стекловидные силикаты, гидросиликаты в кристаллическом и аморфном состоянии – являются так называемыми низкомодульными силикатами с мольным соотношением SiO2/M2O=l÷4. Необходимость улучшения некоторых свойств композиционных материалов на их основе, таких как водостойкость и термические свойства, привели к разработке «высокомодульных жидких стекол» — полисиликатов щелочных металлов. К полисиликатам относят [50] силикаты щелочных металлов (силикатный модуль от 4 до 25), представляющие собой переходную область составов от жидких стекол до кремнезолей, стабилизированных щелочью. Полисиликаты характеризуются широким диапазоном степени полимеризации анионов и являются дисперсиями коллоидного кремнезема в водном растворе силикатов щелочных металлов. Синтез и практическое применение полисиликатов в качестве связующего позволили заполнить существовавший пробел в ряду щелочных силикатных связующих, которые, таким образом, представлены тремя группами по мере уменьшения щелочности: растворимые (жидкие) стекла, полисиликаты, золи кремнезема.
Сравнительно новую область науки о водорастворимых силикатах, нашедшую в настоящее время значительный практический выход, составили силикаты органических оснований. Синтез этого класса соединений основан на способности кремнезема растворяться в области рН выше 11,5 в органических основаниях различной природы, прежде всего в четвертичных аммонийных основаниях. Четвертичные аммонийные основания являются достаточно сильными основаниями для растворения в них кремнезема. Водорастворимые силикаты этого класса – силикаты четвертичного аммония – характеризуются общей формулой [N(R1, R2, R3, R4)]2O1-nSiO2, где R1, R2, R3, R4 – H, алкил-, арил- или алканолгруппы [70,71].
Растворы силикатов четвертичного аммония – это обычно высококремнеземные лиофильные стабильные дисперсные системы, в которых кремнезем присутствует как в коллоидных формах, так и формах, характерных для истинных растворов. Их производят часто в тех случаях, когда натриевые или калиевые аналоги таких систем оказываются недостаточно устойчивыми [50]. Растворенный кремнезем в таких системах представляет собой олигомеры со степенью полимеризации 10÷25, размер частиц коллоидного кремнезема возрастает от 2 до 100 нм в зависимости от значения силикатного модуля системы в пределах n=2÷12. Наибольшее практическое применение нашли низшие алкил- и алканолпроизводные – силикат тетрабутиламмония, силикат тетраэтиламмония, силикат тетраэтаноламмония. Отсутствие в этой группе водорастворимых силикатов ионов щелочных металлов, а также возможность широкого варьирования составом органических оснований открыли новые области применения таких водорастворимых силикатов, отличные от традиционных.
Таким образом, группа жидких стекол – щелочных силикатных растворов весьма обширна. Входящие в эту группу силикатные системы классифицируют по следующим признакам.
По степени полимеризации (l) кремнезема – среднему числу атомов кремния, образующих непрерывную систему силоксановых связей ≡Si–О–Si≡ в процессе полимеризации. При полимеризации кремнезема происходит возрастание его молекулярной массы (М), а при высоких степенях полимеризации – увеличение размера (d) коллоидных частиц кремнезема. При определенной степени полимеризации (l) в щелочных силикатных системах появляется коллоидный кремнезем как в виде золя, так и в виде высокодисперсного гидратированного кремнезема:
Мономеры |
|
Низшие олигомеры |
|
Высшие олигомеры |
|
Коллоидный кремнезем, золи |
(l = 1) |
|
(l = 1÷25) |
|
(поликремневые кислоты, М<105) |
|
(М>105 или, d>2 нм) |
По химическому составу по мере возрастания щелочности, характеризующейся мольным отношением SiO2/M2O (силикатным модулем системы n) щелочные силикатные системы образуют ряд, соответствующий четырем вышеприведенным формам кремнезема:
Высокощелочные системы |
|
Жидкие стекла |
|
Полисиликаты |
|
Золи |
(n<2) |
|
(n = 2÷4) |
|
(n=4÷25) |
|
(n>25) |
По виду катиона жидкие стекла подразделяют на калиевые, натриевые, литиевые и силикаты органических оснований. Синтезируют также смешанные жидкие стекла внутри этих четырех групп [53].
Процессы, которые происходят при отверждении, достаточно сложны и многообразны. Современный взгляд на общее представление об отверждении жидкого стекла как такового и в составе различных гомогенных и гетерогенных систем, наиболее широко встречающихся в практике, представлен в ряде обзоров [50,53,58]. Выполняя роль склеивающего или связующего материала, жидко стекольная система переходит из жидкого состояния в твердое разными способами. Можно разделить их на три типа:
1) потеря влаги испарением при обычных температурах;
2) потеря влаги системой с последующим нагреванием выше 100 °С;
3) переход в твердое состояние путем введения специальных реагентов, которые называют отвердителями. Естественно, что эти три типа могут использоваться в сочетании.
В растворах силикатов степень полимеризации анионов, как известно, зависит от двух факторов — силикатного модуля и концентрации раствора. Каждый раствор имеет некоторое распределение анионов по степени полимеризации. На полимерное распределение накладывается распределение анионов по зарядам, которое также определяется этими двумя факторами.
Одним из способов отверждения жидких стекол является процесс отверждения при обычных температурах за счет удаления влаги. Процессы, происходящие в силикатном растворе, регулируются двумя обратимыми реакциями:
≡SiOH+OH- ![]() ≡SiO-+H2O;
≡SiO-+H2O;
≡SiOH + ≡SiO- ![]() ≡Si–О–Si≡ + OH-.
≡Si–О–Si≡ + OH-.
Полимеры, образующиеся по второй реакции, имеют преимущественно сферическое строение, и в ходе полимеризации формируются как коллоидные частицы, заряженные отрицательно [50,54]. Поэтому они не вступают между собой во взаимодействие, если не созданы условия для коагуляции. Размеры коллоидных частиц и тем самым их концентрация, регулируются процессом внутренне перегонки. Он заключается в том, что растворимость малых частиц кремнезема в растворе зависит от размеров частицы и с увеличением размера растворимость понижается. В ходе внутренней перегонки крупные частицы растут за счет растворения более мелких частиц. Для более крупных частиц растворимость не зависит от размера. Поэтому внутренняя перегонка на какой-то стадии замедляется и останавливается, приводя к некоторому распределению частиц по размерам, если процесс образования раствор силиката начинался от мономерных частиц. Если раствор силикат образовался растворением крупных полимерных форм кремнезема, то внутренняя перегонка может вообще не происходить или развивается как вторичный процесс, и раствор получится с иным полимерным распределением анионов, чем в первом случае. Внутренняя перегонка, особенно на поздних стадиях, протекает достаточно вяло, и состарившиеся и свежеприготовленные растворы могут сильно отличаться друг от друга, хотя модуль и концентрация растворов одинаковы. Резкое разбавление растворов или перемена температуры также приводят к изменениям анионного состава.
Если испарять разбавленный раствор с большим модулем, жидкая фаза будет представлена только ионными формами кремнезема. Однако, из-за гидролиза, обусловленного меньшей концентрацией гидроксильных ионов, в соответствии с первой реакцией, появятся в бошем количестве ионы типа ![]() , а в гораздо меньшем колдичестве ионы
, а в гораздо меньшем колдичестве ионы ![]() . В ходе испарения состав раствора начнет изменяться в сторону уменьшения модуля, поскольку модуль твердой фазы выше модуля исходного раствора (Рис. 7). Концентрация
. В ходе испарения состав раствора начнет изменяться в сторону уменьшения модуля, поскольку модуль твердой фазы выше модуля исходного раствора (Рис. 7). Концентрация ![]() станет меньше, а ионов
станет меньше, а ионов ![]() больше и, по мере испарения, произойдет появление новых твердых фаз и, в конечном счете, станет выпадать фаза Na4SiO4·mН2О.
больше и, по мере испарения, произойдет появление новых твердых фаз и, в конечном счете, станет выпадать фаза Na4SiO4·mН2О.
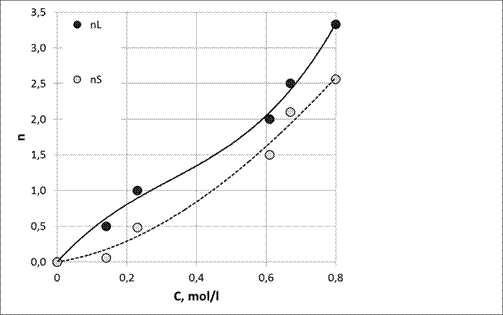
Рис. 7. Концентрация исходного раствора силиката тетрабутиламмония и анионный состав кристаллов, полученных из него [59,60].
При некоторой концентрации гидроксил-ионов в растворе гидролиз ионных форм кремнезема заходи так далеко, что появляются полностью гидролизованные формы достигшие незаряженного молекулярного состояния Si(ОН)4. Если взаимодействие между двумя ионами по типу второй реакции маловероятно из-за электростатического отталкивания, то между молекулярной и ионной формами оно возможно. Так возникают полимерные формы кремнезема. Они уже на ранних стадиях принимают трехмерное строение, где внутренние атомы кремния соединены связями Si–О–Si, а наружные атомы имеют хотя бы одну связь Si–OH. Последняя может существовать также в ионной форме SiO-. При длине цепи, равной 4-5, происходит образование кольцевых структур, приобретающих затем трехмерное строение.
Медленное испарение при повышенной температуре увеличивает степень полимеризации силикатов. Поэтому при получении легкорастворимых порошков щелочных силикатов, с точки зрения качества продукции, целесообразно проводить процесс быстро при низкой температуре, используя не очень концентрированные растворы.
Дальнейшие превращения в отвердевшей силикатной системе связаны с медленной потерей гидратационной воды в атмосферных условиях и с поглощением углекислого газа СO2 + OН- ![]() НСO 3 -, что вызывает миграцию ионов натрия к поверхности, образование кристаллических карбонатных структур и формирование маловодного кремнеземного каркаса. Последнее приводит к возрастанию водостойкости системы.
НСO 3 -, что вызывает миграцию ионов натрия к поверхности, образование кристаллических карбонатных структур и формирование маловодного кремнеземного каркаса. Последнее приводит к возрастанию водостойкости системы.
Другим путем отверждения жидких стекол является процесс их отверждение реагентами. Особое место среди отвердителей, повышающих модуль жидкого, стекла, занимают гексафторсиликаты щелочных металлов. Их особенность заключается в том, что они не только взаимодействуют со щелочью, понижая ее содержание, но выделяют при своём разложении кремнекислоту, которая в твердеющей системе заметно уплотняет ее, понижая пористость. Реакция протекает между гексафторсиликат ионом и гидроксил ионами по следующей условной схеме:
SiF6- +4OH- ![]() SiO2·2H2O + 6F-
SiO2·2H2O + 6F-
Это типичная реакция замены лиганда в комплексах, но она сопровождается изменением координационного числа атома кремния и, как часто бывает в таких случаях, комплексы со смешанными лигандами оказываются весьма неустойчивыми. Реакция обратима и в кислых средах протекает в обратном направлении. Введение порошка Na2SiF6 в натриевое жидкое стекло, как и в других случаях смешения с твердыми кислыми отвердителями, сразу вызывает коагуляцию силиката и гелеобразование вокруг поверхности зерна. Поэтому порошок гексафторсиликата натрия обычно предварительно смешивают с наполнителем, а затем уже с жидким стеклом.
При получении кислотостойких бетонов и замазок гексафторсиликат натрия, вводят в количестве большем, чем нужно для нейтрализации всей щелочи жидкого стекла [61]. Так например, для нейтрализации всей щелочи, содержащейся в натриевом жидком стекле (n = 3, ρ=l,45 г/см3), гексафторсиликат натрия требуется чуть меньше 16% от массы стекла, при n = 2 и ρ=1,40 г/см3 необходимо 18 масс. % гексафторсиликата натрия. Рекомендуемые рецепты предлагают 25÷30 масс. % Na2SiF6 для кислотостойких замазок [50,52-54,61,62]. После нейтрализации всей щелочи жидкого стекла разложение гексафторсиликата натрия полностью прекратится, и это означает, видимо, что в затвердевшей системе практически целесообразно одновременное присутствие и Na2SiF6, и кремнекислоты. Важно также отметить, что в кислой среде написанная реакция пойдет в обратном направлении, если NaF, образовавшийся при изготовлении замазки, будет присутствовать в системе в достаточной концентрации. Поэтому отмывка NaF после затвердевания будет способствовать увеличению кислотостойкости как из-за удаления открытого для влаги NaF, так и вследствие вступления в реакцию еще части Na2SiF6 и забивки пор кремнегелем.
К отвердителям жидкого стекла относятся сложные эфиры легких органических кислот, а также эфиры угольной и кремневой кислот, омыляющиеся под действием щелочи жидкого стекла: RCOOR'+OH- ![]() RCOO- + R'OH.
RCOO- + R'OH.
Различные эфиры имеют свои константы скорости этой реакции. Но большинство используемых эфиров-отвердителей весьма ограниченно растворимы и образуют самостоятельную фазу в виде капель эмульсии. Вокруг этих капель образуются силикатные полупроницаемые мембраны, которые разрываются осмотическим давлением, и механизм действия таких отвердителей оказывается сложным. Состав отвердителя для данного технологического объекта подбирается смешением различных эфиров замедляющих или ускоряющих процесс, а также отрабатывается его необходимая дозировка.
Отверждение жидкого стекла может также осуществляется путем его взаимодействия с нейтральными электролитами и водорастворимыми органическими веществами [52-55]. Данный процесс широко описал в технологии получения силикагелей, но непосредственно не используется в вяжущих системах. Существует большое количество технологий, в которых получают структуры, обладающие самой различной пористостью, прочностью в затвердевшем состоянии. При осуществлении этих процессов варьируют температуру процесса, тип и концентрацию добавляемой соли, концентрацию и модуль раствора жидкого стекла, время выдержки системы при рН в диапазоне слабощелочных растворов. Эти работы подробно описаны в обзоре [50,54].
Также отвердителями жидкого стекла являются соединения кальция и других двух- и трехвалентных металлов [36,64]. Взаимодействие растворов силикатов с соединениями кальция занимает важное место в прикладной химии. Осаждаемые солями кальция из растворов жидкого стекла силикаты кальция аморфны при обычной температуре. Кристаллические продукты могут образовываться при повышенном давлении и температуре в автоклавах, или из очень разбавленных растворов с низкой щелочностью, а также при старении. Осаждение силикатов щелочноземельных, многовалентных и тяжелых металлов возможно, как правило, при рН чуть меньших, чем рН осаждения соответствующих им гидроксидов. Поэтому при смешивании двух растворов, кроме силикатов металлов всегда образуются гидроксиды металлов и кремнегели. Их образование происходит всегда в большем или меньшем количестве в зависимости от интенсивности перемешивания. Порядок их образования зависит от природы реагирующих веществ. Результат взаимодействия растворов солей двух и трехвалентных металлов с жидким стеклом заключается в коагуляции силикатного раствора [67]. Состав выпавшего аморфного осадка существенно зависит от того, что к чему приливали, от интенсивности перемешивания, от концентрации используемых растворов, от рН образовавшейся реакционной смеси и может включать в себя как гидроксиды кремния и соответствующего металла, так и их силикаты с захваченными ионами анионами. Такой характер взаимодействия наблюдается с большинством солей двух- и трехвалентных металлов. Этот процесс называют соосаждением или сокристаллизацией гидроксидов металла и кремния, или адсорбцией гидроксида металла на коллоидном кремнеземе или, наоборот, об осаждении кремнезема на оксидах и гидроксидах металлов. Такие взаимодействия широко используются в цветной металлургии и в радиохимии для выделения и разделения ценных и радиоактивных элементов [68].
1.5. Получение нанокомпозитов через аэрогели
Композитные материалы получают путем объединения двух различных материалов. В общем, создание композитов используется для того, чтобы использовать преимущества каждого типа материала, и минимизировать их недостатки. Например, аэрогели кремнезема являются хрупкие субстанциями. При этом другой компонент в полученном материале, может увеличивать прочность материала, который, в свою очередь, имеет желаемые оптические свойства, высокую площадь поверхности и низкую плотность как у аэрогеля кремнезема.
Помимо этих синтеза и методов обработки, необходимо подчеркнуть, что гибкость золь-гель процессов позволяет увеличить выбор аэрогелей кроме диоксида кремния, аэрогелями на основе материалов, который в настоящее время доступны. Архитектура массивных материалов может быть адаптирована с использованием темплатных методов [72]. Химия геля может быть изменена путем прививки, либо во время до [73] или после гелирования [74].
Композиты и нанокомпозиты могут быть созданы путем пропитки пен или волокнистых сеток, диспергирования частиц [75], порошков [76], или полимеров [77], или путем синтеза смешанных оксидов на основе диоксида кремния [78, 79], или оксидов других металлов [54,56]. Органические гибриды кремнезема [80] также могут быть изготовлены путем многих методов, таких как со-гелирование и сшивка [81] или взаимодействием с функционализированными частицами [82].
За последние годы было проведен большой объем исследований в области получения энергетических материалов. Были работы по применению материалов на основе аэрогелей и золь-гель-производных, для получения наноструктурированных энергических композитов (например, взрывчатых веществ, ракетного топлива и пиротехнических составов), а также изучены их характеристики. Аэрогели имеют уникальную плотность, состав, пористость и размеры частиц, а также низкую температуру и мягкие условия химических методов синтеза, все это делает их привлекательными в качестве кандидатов для создания энергетических наноматериалов.
Применение этих материалов и методов в этой области технологии привело трем основным типам золь-гель энергетических материалов [87]:
1) пиротехника – неорганические золь-гель окислители / металлическое топливо (термитные композиты);
2) золь-гель-производные пористых пирофорных металлических порошков и пленок;
3) органическое золь-гель топливо / неорганические нанокомпозитные окислители (композитные твердые ракетные топлива и взрывчатые вещества).
Поведение всех золь-гель наноструктурных энергетических материалов в значительной степени зависит от нескольких факторов, в том числе площади поверхности, степени смешения между фазами, тип перемешивания (золь-гель или физическое смешивание твердых веществ), способа загрузки твердых частиц, и присутствия примесей. Золь-гель методы привлекательны для области получения наноструктурированных энергетических материалов. Эти методы предлагают много вариантов формы получаемых материалов, таких как монолиты, порошки и пленки, а также имеют широкую композиционную универсальность. Эти атрибуты, в сочетании со строгостью синтетического контроля микроструктурных свойств золь-гель матрицы, обеспечивают подготовку энергических нанокомпозитов с перенастраиваемыми характеристиками.
Энергетические материалы разделяются на три класса[88]:
1) взрывчатых веществ;
2) твердые ракетные топлива;
3) пиротехнические материалы.
Таким образом, материалы могут быть классифицированы, на основе их скоростей межфазного взаимодействия их реагентов, а также типа энергетического выхода. Взрывчатые вещества, это материалы, которые реагируют на сверхзвуковой скорости (детонация), и чьи продукты реакции, прежде всего, являются газообразными веществами. Ракетное топливо также реагирует быстро, и дает, в основном, газообразные продукты реакции, но реагируют, в отличие от взрывчатых веществ, с дозвуковыми скоростями. Пиротехнические материалы, как правило, реагируют наиболее медленно из всех трех видов энергетических материалов и генерируют высокотемпературные твердые продукты реакции и мало газообразных, и генерируя при этом интенсивный видимый световой поток.
По крайней мере, два прошедших десятилетия область нано исследований была одним из самых активных направлений исследований в различных научных дисциплинах, и энергические материалы не были исключением из этого [88,96]. Благодаря использованию наноматериалов и передовых технологий изготовления, синтезированы наноэнергетические композиты, которые имеют перспективные возможности. Энергетические нанокомпозиты определяются как смеси окислителя и топлива, частицы которых имеют размеры, или, по крайней мере, один критический размер менее 100 нм [97]. Уменьшение размера увеличивает площадь поверхности контакта между фазами реагентов. Это было достигнуто с использованием различных методов, включая методы конденсации пара [98], мицеллярного синтеза, химическим восстановлением, ультразвуковым смешения [99], а также механическими методами смешения [100]. Были получены очень хорошие результаты [101]. В качестве примера, для пиротехнических нанокомпозитов Al/МоО3 были зафиксированы скорости горения почти на три порядка больше, чем у обычных смесей [102]. Кроме того, такие свойства энергетических материалов, как чувствительность к воздействиям, зависят от размера частиц. Энергетические материалы с меньшими размерами частиц могут быть менее чувствительны к зажиганию и, таким образом, обладают лучшими свойствами с точки зрения безопасности [103]. Эти два важных примера дают мощный стимул для применения наноматериалов и технологий в энергетических областях. Имея это в виду, аэрогели и другие гелеобразные материалы, полученные из золей, были исследованы в последнее десятилетие в качестве наноструктурированных энергетических материалов.
Наряду с хорошей смешиваемостью энергетические нанокомпозиты имеют чрезвычайно высокие площади поверхности раздела фаз, золь-гель метод получения этих материалов позволяет обеспечить еще большие межфазные зонах контакта. Все эти благоприятные атрибуты привели к активным исследования по применению золь-гель химии к исследованиям и разработкам энергетических материалов.
Органоминеральные нанокомпозиты, на основе аэрогелей кремнезема, обладают комплексом уникальных оптических свойств. Показатель преломления аэрогеля, модифицированного триметилсилильными группами может находиться в диапазоне 1.008-1.06, в зависимости от их плотностей. На рисунке 8 показана зависимость между плотностью и показателем преломления TMSA аэрокремнегеля. Относительное значение показателчя преломления n, почти пропорционально плотности материала аэрогеля в диапазоне высокой пористости. Этот результат соответствует теории «отношения Максвелла-Граната", опубликованной впервые в 1904 году, в применении к нанокомпозитам, составленным органически модифицированным оксидом кремния и воздухом.
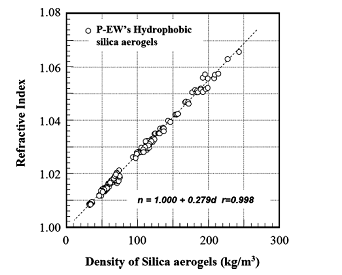
Рисунок 8. Корреляция между плотностью и индексов преломления гидрофобных аэрогелей кремнезема (Panasonic Electric Works Co., Ltd. P-EW).
Так как модифицированные аэрогели обладают превосходными оптическими свойствами, прозрачностью, экстремально низкий индекс показателя преломления и влагостойкостью, они был часто используется в качестве среды в счетчиках Черенкова. Когда заряженная частица проходит через прозрачную среду со скоростью быстрее, чем скорость света в материале, возникает свечение, открытое П.А.Черенковым, и впервые опубликованное им в журнале Physical Revue в 1937 году. Хотя монолитные блоки аэрогеля диоксид кремния, производимые методами сверхкритических способов сушки, довольно дороги для промышленного применения, они внесли большой вклад в прогресс в таких научных областях, как физика высоких энергий. Прогресс науки всегда способствовали улучшению научных исследований и разработок в промышленном мире, поэтому можно ожидать, что аэрогель может стать пионером новых технологий, таких как нанокомпозиты, оптика, космические исследования, энергетические устройства, и так далее [87,91,92].
Активные работы ведутся в области наноразмерной инженерии композитов на основе кремнезема для создания различных сенсоров [85,93,94]. В работе [93] они описаны как "композиты кремнезем – модифицированный кремнезем", подготовленный после модификации геля кремнезема при гелеобразовании, катализируемом основанием, с другим золем диоксида кремния, на этот раз полученным с использованием катализа кислоты. Этот катализируемый основанием кислотно-модифицированный гель затем обрабатывают с помощью метода углекислотной суперкритической экстракции для получения аэрогеля. Монолиты аэрогеля, полученные в результате такого процесса, имеют объемные свойства аэрогелей диоксида кремния, полученных основным катализом, в том числе с хорошей прозрачностью, при этом поверхностные свойства оказываются более типичными для аэрогеля, полученного методом кислотного катализа. Следовательно, можно улавливать различные виды сильнополярных молекул, в том числе кислотно-основных индикаторов, и использовать их в качестве интерфейса в соответствующих сенсорах.
В работе [85] сообщается о композитных аэрогелях диоксида кремния, содержащих металлические коллоидные частицы (золота или платины), которые имели оптическую прозрачность аэрогелей кремнезема, в сочетании с поверхностными и оптическими свойствами металлического коллоида. Металлические коллоидные частицы равномерно распределены по всему объему смеси и, следовательно, изолированы друг от друга. В то же время, пористость матрицы кремнезема делает эти металлические частицы коллоидов доступными для частиц, которые проходят через матрицу. Поверхность металлического коллоида может быть изменена либо до, либо после гелеобразования, чтобы адаптировать ее к оптическим свойствам материала.
Впоследствии этот метод был применен к подготовке монолитов аэрогеля легированных белком cytochrome c [94]. В буферном растворе, белок образует надстройку, содержащую тысячи отдельных белковых молекул вокруг одной частицы коллоидного золота. Модифицированные частицы золота подвергают взаимодействию с TMOS катализируемых основанием, золь для получения композитного материала, получали как описано в [85]. Несмотря на то, что фрагменты cytochrome c на внешней части надстройки были повреждены во время процесса обмена и экстракции растворителем, большинство внутренних белков пережили процесс экстракции без изменений, в среде, подобной буферу, вокруг частиц золота. Эти монолиты аэрогеля сохранили некоторую реакционную способность cytochrome c, как показала их реакция на наличие NO в газовой фазе, наличие которого контролировалось по изменению величины оптической плотности с течением времени.
Отметим, что относительно низкая температура процесса при использовании метода углекислотной суперкритической экстракции имеет большое значение для сохранения функции белка в этом приложении. При использовании процесса быстрой суперкритической экстракции не следует ожидать сравнимых результатов, потому что этот белок не выжит более высокие температуры, необходимые, для осуществления такого процесса сушки.
В работе [86] описаны предварительные результаты, которые демонстрируют, что включение нановолокон полианилина в аэрогеле диоксида кремния, полученном на основе TMOS и углекислотной суперкритической экстракции, приводит к увеличению прочности материалов. При этом появляется возможность их потенциального применения для обнаружения газообразных кислот и оснований. Было обнаружено, что в том числе при введении всего около 6% полианилина от веса материала, была увеличена прочность аэрогеля в три раза, при получении материала такой же низкой плотности (0,088 г/см3). При использовании золотых электродов на поверхности композитного аэрогеля, было обнаружено резкое снижение сопротивления, когда аэрогель подвергали воздействию паров HCl.
После проведения всей стадий процесса синтеза, аэрогель является твердым, аморфным, но чрезвычайно пористым (75-99% пористости) материалом. Последний шаг в трансформации является его уплотнение путем тепловой обработки. Часто бывает необходимо преобразовать материал путем спекания аэрогеля в твердое стекло, лишенное пористости, то есть, с относительной плотностью равной 1. Относительная плдотность – отношение между объемной плотностью аэрогеля и плотностью кварцевого стекла (2,2 г/см3). На рис. 9 показана типичная эволюция относительной плотности и удельной площади поверхности во время спекания путем термообработки. Эти кривые, сильно зависят от температуры термообработки, и от содержание гидроксильных групп в структуре аэрогеля, которые влияют на вязкость аэрогеля [93].
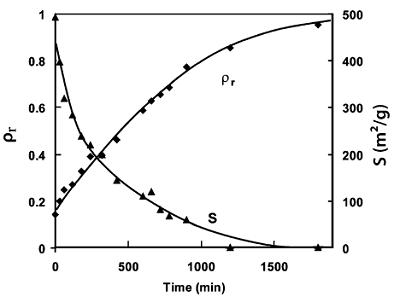
Рисунок 9. Эволюция аэрогеля относительной плотности ρr (1) и удельной поверхности S (2) в зависимости от времени спекания при 1000 ![]() [35,93].
[35,93].
Гели, которые изначально некристаллические могут кристаллизоваться во время последующей термообработки. Успешное образование стекла является результатом конкуренции между явлениями, которые приводят к уплотнению и те, которые способствуют кристаллизации [93, 94].
Из этих данных следует важное применение нанокомпозитов на основе аэрогелей оксида кремния, является герметизация радиоактивных отходов атомных электростанций. Актиниды и другие радионуклиды, генерируемые в ядерном топливном цикле, представлены в виде солей в водных растворах. Пользуясь полностью открытой пористой структурой аэрогеля, можно заполнить растворами этих солей весь объем аэрогеля. Затем жидкую фазу удаляют испарением, а пористый композиционный материал (аэрогель + соль) полностью спекают, что приводит к синтезу многокомпонентного материала. Пористая структура аэрогеля используется в качестве принимающего объема. В соответствии с малым размером пор аэрогеля, подготовка такого нанокомпозита является очень простым процессом. Размер доменов будет зависеть от размера пор в аэрогеле и от содержание актинидов в жидкости.
Тем не менее, если пытаться заполнить аэрогель с жидкостью, такой как вода, капиллярные силы могут вызвать разрушение аэрогеля [95]. Благодаря сложности текстуры аэрогеля, подробный расчет локальных напряжений при заполнении его жидкостью произвести трудно, он зависит от поверхностной энергии жидкость-пар и размера пор. Таким образом, чтобы избежать растрескивания материала во время заполнения, могут быть предложены различные стратегии:
1) синтез аэрогеля с большими порами, которые уменьшат величину капиллярных сил;
2) улучшение механической прочности аэрогеля, за счет его частичного состаривания и спекания;
3) поверхностная функционализация, за счёт привития к поверхности аэрогеля хелатообразующих группировок.
2. СМЕСИТЕЛЬНЫЕ ТЕХНОЛОГИИ ПОЛУЧЕНИЯ НАНОКОМПОЗИТОВ
Метод получения полимерных нанокомпозитов в расплаве, так называемый экструзионный метод, состоит в смешении расплавленного полимера с частицами глинистого материала, модифицированного с поверхности органическими соединениями. В ходе интеркаляции полимерные цепи в существенной степени меняют форму и теряют конформационную энтропию. Вероятной движущей силой для этого процесса является важный вклад энтальпии взаимодействия полимер-глинистый материал при смешении. Стоит добавить, что полимерные нанокомпозиты на основе глинистых материалов успешно получают экструзией [104,107]. Преимуществом экструзионного метода является отсутствие каких-либо растворителей, что исключает наличие вредных стоков, скорость процесса значительно выше, технологическое оформление производства – более простое. То есть для получения полимерных нанокомпозитов в промышленных масштабах экструзионный метод является наиболее предпочтительным, требующим меньших затрат на сырьё и обслуживание технологической схемы.
При получении полимер-силикатных нанокомпозитов в растворе органомодифицированный силикат набухает в полярном растворителе, таком как толуол или N-диметилформамид. Далее к нему добавляется раствор полимера, который проникает в межслоевое пространство силиката. После этого проводится удаление растворителя путем испарения в вакууме. Основное преимущество этого метода заключается в том, что "полимер-слоистый силикат" может получаться на основе полимера с низкой полярностью или неполярного материала. Тем не менее, этот метод не находит широкого использования в промышленности по причине большого расхода растворителя [105].
Метод получения полимерных нанокомпозитов в расплаве состоит в смешении расплавленного полимера с частицами органомодифицированного глинистого материала. Получение полимерного нанокомпозита в процессе синтеза самого полимера заключается в интеркалировании мономера в слои глины. Мономер мигрирует сквозь галереи органоглины и полимеризация происходит внутри слоев. Реакция полимеризации может быть инициирована нагреванием, излучением или соответствующим инициатором [106].
На характер кривых оказывают влияние различные параметры – размеры исходных агломератов частиц и образуемых ими микроструктур, силы, действующие между частицами и способствующие образованию агломератов, процессы, возникающие при течении структурированной композиции. После приложения сдвиговых усилий макроагломераты наполнителя разрушаются в первую очередь, что находит отражение на результатах реологических измерений. Переходный промежуток, соответствующий периоду времени от начала разрушения макроагломератов до наступления равновесия, характеризуется плавным изменением интенсивности рассеянного света. В исследуемых системах разрушение агломератов с образованием отдельных частиц или их устойчивых соединений и достижение ими равномерного распределения в объеме связующего, подтвердилось микроскопическими наблюдениями проб дисперсных композиций [142]
Частицы высокодисперсного наполнителя также способны образовывать непрерывные структуры, пронизывающие весь объем системы и приводящие к изменению макроскопических свойств олигомерной композиции. В первую очередь речь идет об увеличении диссипации энергии при течении и, следовательно, об изменении реологических свойств, а именно об увеличении вязкости композиции. В случае использования электропроводящего наполнителя, например сажи, при создании пространственных непрерывных структур произойдет существенное изменение свойств композиции, материал станет электропроводящим. Очевидно, что при этом длина непрерывных цепей должна быть соизмерима с расстоянием между электродами. Следовательно, электропроводимость наполненных композиций является более чувствительным параметром процесса создания непрерывных пространственных структур частиц, чем вязкость композиции. Резкое возрастание вязкости, по-видимому, возможно и при структурообразовании частиц, не приводящем к образованию структур, размеры которых соизмеримы с размерами пространства между электродами.
Таким образом, для получения электропроводящих композиций на основе высокодисперсных компонентов необходимо построение цепей частиц, размеры которых на много порядков превышают размеры частиц, и число частиц в цепи составляет тысячи и десятки тысяч. Очевидно, что такие сложные образования легко подвержены разрушению. Можно предположить, что эти крупные частицы могут выступить центрами сгруктурообразования частиц сажи. Размеры непрерывных цепей частиц сажи, необходимые для получения электропроводящей системы, в этом случае существенно уменьшатся.
На рис. 10 (а) представлены относительные зависимости для величины электрического тока, показывающие, во сколько раз в равных условиях электропроводимость композиции с графитом и сажей больше электропроводимости композиции только с сажей.
Проведенные исследования показали, что введение в олигомер 22 масс.% графита не приводит к появлению электропроводимости исследуемой композиции, при этом олигомер, содержащий 3 масс.% сажи, обладает электропроводящими свойствами (рис. 10, а). Однако введение в композицию, содержащую 3 масс.% сажи, графита приводит к резкому увеличению электропроводности всей системы. При этом увеличение скорости сдвига приводит к разрушению внутренней структуры композиции и уменьшению ее электропроводимости. На рис. 10 (б) показаны аналогичные зависимости для повышенной температуры. Как следует из приведенных данных, влияние графита возрастает с увеличением скорости сдвига. При этом максимальное влияние графита при температуре 60°С соответствует скорости сдвига 10 с-1. Увеличение температуры до 80°С приводит к возрастанию данного значения скорости сдвига примерно до 20 с-1 [143].
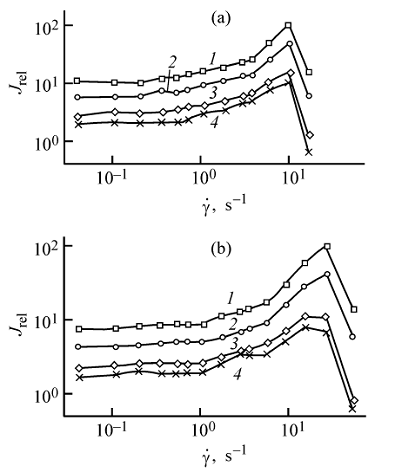
Рис. 10. Зависимость относительной электрической проводимости композиции, содержащей 3 масс. % сажи, от скорости сдвига у при 60 (а) и 80°С (б). Содержание графита (мас%): 1 – 20, 2 – 10, 3 – 5, 4 – 2.5.
3. РАЗЛИЧНЫЕ ТИПЫ НАНОФАЗЫ
3.1. Наноразмерный наполнитель
Новое направление в технологии керамики и неорганических композитов – формование материалов из растворов с использованием золь-гель процессов. Сущность этих процессов заключается в применении золей – коллоидных растворов, соответствующих оксидов и оксигидратов металлов, обладающих способностью в определенных условиях превращаться из жидких систем в твердые продукты.
Наиболее важными факторами, характеризующими совершенство процесса синтеза золей, служат: агрегативная устойчивость, максимально достигаемая концентрация, монодисперсность золя.
Классическими способами получения золей являются диализ и электродиализ, ионный обмен, пептизация гелей, гидролиз, электролиз соединений металлов.
Самым распространенным способом получения гидрозолей, в частности, оксидов кремния и циркония в настоящее время является метод ионного обмена. Ионообменный метод отличает простота, не требуется предварительная очистка сырья, получают достаточно концентрированные золи, содержащие небольшое количество электролитных примесей. Ионообменному способу получения золей кремнезема посвящено много работ [36,108-110]. В [36] описана стандартная методика получения кремнезоля, обеспечивающая наиболее воспроизводимые свойства конечных продуктов его использования – сорбентов. Полученный золь отличается тем, что в нем отсутствуют посторонние электролиты, и его можно стабилизировать щелочами. Предложено проводить подщелачивание получаемого ионообменным способом золя, специально приготовленным щелочным золем, что позволяет избежать повышенного содержания щелочного металла [36]. Существует несколько вариантов метода получения золя кремневой кислоты ионным обменом [109,110]. Раствор силиката натрия пропускают через неподвижный слой катионита сверху или снизу, последнее позволяет лучше использовать смолу. Ионообменную смолу можно добавлять в раствор силиката натрия, используя обычный реактор с мешалкой, или их вместе подавать в реакционную среду, где поддерживается необходимое постоянное значение рН [108]. В последнем случае можно одновременно вести выращивание частиц.
Электродиализный метод выгодно отличается тем, что процесс можно вести непрерывно, получая концентрированные, практически чистые золи [36,114]. При успешной реализации метода отпадает необходимость в проведении регенерации и обезвреживании сточных вод. Однако, использование этого метода находится в нашей стране на стадии научно-исследовательских и опытных разработок. Метод электродиализа не получил пока широкого распространения вследствие жестких требований, предъявленных к золю в отношении содержания натрия и размера частиц на электродах [109,110]. В [116] предложен способ получения золей элементов (кремния, алюминия, сурьмы, хрома, марганца, олова), включающий электродиализный перенос катионов щелочных металлов, содержащихся в водном растворе соли при тщательном и непрерывном регулировании рН раствора.
Учитывая недостатки вышеприведенных методов, был разработан метод, представляющий из себя совмещение ионного обмена и электродиализа для регенерации смолы. Эти процессы идут одновременно, что позволяет однажды загруженную смолу использовать для непрерывного получения раствора кремневых кислот. Продуктом регенерации является раствор щелочи, который может быть использован в этом же производстве.
Промышленное применение находит метод предварительного получения геля и последующей его пептизации. Получение силиказоля осуществляется взаимодействием силиката натрия и кислоты. После промывки от солей свежеосажденный гель смешивают с водным раствором аммиака и пептизируют под давлением при температуре 200°С. Полученный золь, содержащий 3% SiO2, выпаривают до содержания 20÷25% SiO2 [109]. В связи с потребностью получения устойчивых золей высокой концентрации используется две разновидности пептизации [36]: адсорбционная и десолюционная. Недостатками метода пептизации является сравнительно большой объем аппаратуры, который требуется для его осуществления, а также неполное диспергирование, и существование агрегатов в получаемом золе.
Золи оксидов металлов могут выть получены гидролизом соединений, например, алюмозоль – гидролитическим разложением алюмината натрия, а кремнезоль – гидролитическим разложением щелочных силикатов [66].
Таким образом, выбор того или иного способа получения золей гидроксидов металлов будет зависеть от области применения конечного продукта (сорбенты, катализаторы, связующие и т.д.), что в свою очередь определяется такими свойствами золей, как концентрация, дисперсность, рН, чистота и т.д.
Во многих случаях целевые свойства золя определяет размер частиц, например, установлено [109], что оптимальные связующие свойства кремнезоля наблюдаются у частиц с размерами в диапазоне 6÷12 нм, при этом обеспечивается большая поверхность контакта.
В настоящей работе диаметр частиц определялся методом адсорбционного титрования [65] и методом ультрацентрифугирования. Исходный, свежеприготовленный кислый золь (рН 2,5) имеет размер частиц. 2÷2,2 нм. Кинетику роста частиц кремнезема целесообразно было рассмотреть в двух областях в кислой (рН 2,5) и щелочной (рН 7,5) при комнатной температуре.
Продолжительность жизни кислого золя SiO2 – 3%) составляет 14 дней. Было установлено, что в течение этого времени частицы практически не растут, их средний размер сохраняется на уровне 2,0÷2,4 нм. В золе, стабилизированном щелочью до рН 8 полимеризация протекает до некоторого значения, отвечающего удельной поверхности 500 м2/г, что соответствует размеру частиц 4,5÷5,0 нм. Реакция поликонденсации, протекающая между силанольными группами, в течение процесса старения золя, приводит к росту рН.
В следующих экспериментах изучалась полимеризация кремнезема под действием температуры в щелочной области. Экспериментально установлено, что рост частиц под действием температуры в основном происходит за первые 60 минут (рис. 11). Затем скорость роста частиц резко снижается. Так, в течение 60 минут размер частиц увеличивается в 2-2,5 раза, в дальнейшем изменяется незначительно.
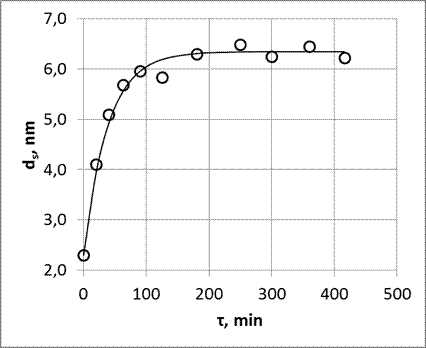
Рис. 11. Влияние времени термостатирования на размер коллоидных частиц кремнезоля
Влияние температуры изучалось в диапазоне 60÷100 ℃ на образцах золей, полученных на основе жидкого стекла и метасиликата натрия с концентрацией двуокиси кремния 3%. Термостатирование проводилось в течение 60 минут, рН золей 8 (Рис. 12). Как видно из рис. 12, с ростом температуры значения размера частиц во всём исследуемом диапазоне значительно увеличивается, каждой температуре соответствует свой конечный размер частиц (от 3 до 7 нм). Рост частиц происходит за счёт ускорения реакции полимеризации и увеличения растворимости SiO2, при этом дисперсионная среда обогащается гидроксильными ионами, которые дополнительно ускоряют процесс.
Кроме того, экспериментальные данные показали (рис. 12), что средний размер коллоидных частиц в золях, полученных из жидкого стекла при всех температурах несколько больше, чем в случае метасиликата натрия, что, вероятно, связано с большей степенью полимеризации кремний кислородного каркаса из-за более высокого силикатного модуля у жидкого стекла, чем у метасиликата натрия.
Рис. 12. Влияние температуры термостатирования на размер коллоидных частиц кремнезоля: 1 – из жидкого стекла; 2 – из метасиликата натрия
Таким образом, экспериментально получены временная и температурная зависимости размеров частиц, отображающие так называемый процесс старения золей. Старение золя — это сравнительно медленный, по отношению к гелеобразованию, процесс изменения его свойств, связанный с реакциями поликонденсации и агрегации. Процесс старения без дополнительных воздействий может перейти в процесс гелеобразования. Старение кислого кремнезоля проявляется в изменении его эффективной вязкости, что обусловлено агрегацией частиц. Старение щелочного кремнезоля проявляется в изменении функции распределения его частиц, увеличении среднего размера его частиц.
3.2. Наноразмерное связующее
Силикаты четвертичного аммониевого основания (QAS), органоминеральные поверхностно-активные вещества общей формулы [R1R2R3R4]N)2(SiO2)n-1SiO3, где R1,R2,R3,R4 различные органические радикалы. По сравнению с силикатами натрия/калия, стабильные водные растворы QAS могут легко иметь n(модуль) в размере 5-10 и более. Вариации модуля и радикалов разрешают изменения свойств QAS в очень широком спектре [70]. QAS совместимы с большинством минеральных и органических соединений при достаточно высоком значении рН, чтобы избежать осаждения кремнезема. QAS имеют хорошую адгезию к гидрофильным и гидрофобным поверхностям и имеют следующие применения:
1) в качестве четвертичных аммониевых соединений:
- в качестве биоцидов;
- в качестве катализаторов;
- в текстиле (если имеют две длинные цепочки) – текстильные смягчители для домашнего использования;
- в качестве ополаскивателя в посудомоечной машине;
- как ополаскивать после шампуня, эмульгаторов;
- в металлообработке – в качестве добавки к кислотам, используемым в процессах очистки и травления стали для предотвращения водородной коррозии;
- в дорожном строительстве, при бентонитовой обработке масляных разливов;
- для антистатической обработки полимеров, например, ПВХ бельтинга;
- для приготовления высококачественного тонера;
- в качестве компонентов в специальных систем очистки воды [125];
- в качестве компонентов, самотвердеющих смесей для изготовления химически стойких материалов и в качестве добавок в бетон и шпаклевки [126];
- в структурно-направляющие агенты, напр., для синтеза молекулярных сит с высокомодульным кремнеземом [127];
- в качестве сырья для приготовления органосилоксанов [128];
- агрегированные пигментные продукты на основе диоксида титана, содержат QAS для пигментной подготовки [129];
2) как силикаты:
- для гидрофильных смесей медицинского назначения [127];
- как связующие вещества для бетона;
- для армирования бетона и других строительных направлений;
- для покрытий, футеровок и замазок.
Композиции на основе QAS обеспечивают покрытия, характеризующиеся отличной адгезией, термостойкостью, огне - и коррозионной стойкостью. В зависимости от добавок, они могут быть изоляторами или электрическими проводниками.
Однако, разработка QAS и материалов на их основе является очень сложным процессом из-за трудностей в моделировании QAS систем. Оксид кремния и твердые QAS имеют разветвленные сшитые структуры, которые недоступны для традиционных методов моделирования.
Существующие методы исследования, таких процессов включают в себя два принципиальных подхода: случайное моделирование методом Монте-Карло и термодинамическое описание.
Подход Монте-Карло рассматривает твердофазный процесс формирования микропористого кластера, как случайный процесс, в котором, изначально пустое, пространство делится на ячейки, каждая из которых может быть, в конечном счете, заполнена твердыми частицами (диоксидом кремния). Вероятность такого события предполагается независимой от предыстории процесса. Главный недостаток этого подхода состоит в игнорировании определения этого процесса. Поэтому такое приближение применимо только к твердотельным структурам с очень низкой плотностью, в которых вероятность соседства двух или более пустых ячеек является незначительным [130-132]. Применимость подхода Монте-Карло ограничена тремя главными факторами: ограниченностью изучаемой системы (для разных мощностей компьютеров, от несколько тысяч до несколько миллионов клеток), ничтожностью поверхностного натяжения, и абсолютной случайностью процессов образования микропор. Следовательно, обоснованность метода Монте-Карло для большей части реальных системах очень сомнительна.
Альтернативный подход касается термодинамического определения рассматриваемого процесса, без учета возможности осаждения кремнезема [133,134]. Термодинамический подход использует макроскопическое описание, основанное, в основном, на том или ином распределении структурных элементов в энергии. Этот подход вполне применим к системе, состоящей из очень большого числа клеток, и позволяет получить очень важную информацию о микропористой системе и зависимости ее свойств от условий приготовления. Однако, поскольку распределение энергии, не относится непосредственно к внутренней площади поверхности, то при этом она не может быть найдена из уравнения термодинамической модели [71,117].
Была рассмотрена проблема агрегации кремнезема из раствора четвертичного аммониевого основания в ограниченном объеме. Система была описана моделью, объединяющей метод Монте-Карло с термодинамическими ограничениями. Термодинамические характеристики были оценены с помощью статистического полимерного метода (предположение равновесия). Модель была использована для оценки таких характеристик, как концентрация мономера и извилистость. Результаты компьютерного моделирования были использованы для прогнозирования свойств покрытий и практической подготовки образцов с покрытием композициями на основе силиката четвертичного аммониевого основания [112,115].В последние годы начало развиваться применение полимерсиликатных композиционных материалов, представляющих собой водорастворимые силикаты с активными добавками веществ фуранового ряда. Они работают в условиях кислых и нейтральных сред и под воздействием повышенных температур. Материалы являются дешевыми и простыми в изготовлении, нетоксичными, негорючими. Стоимость полимерсиликатных материалов соизмерима со стоимостью цементных бетонов и в несколько раз ниже стоимости полимербетонов. Полимерсиликатные материалы в виде бетонов, растворов, замазок применяют для изготовления конструкций различного назначения, монолитной и штучной футеровки. Наблюдается определенная перспектива у композиционных материалов на основе связующего жидкого стекола, модифицированного фурфуриловым спиртом [113].
Существенное увеличение прочности, термо- и огнестойкости силикатной матрицы достигается путем введения в композицию тетрафурфуриловых сложных эфиров ортокремневой кислоты (тетрафурфурилоксисиланы – ТФС). Эффект достигается за счет упрочнения контактов между глобулами силикагеля и модификации щелочного компонента благодаря «прививке» фуранового радикала. Введение в связующее, добавки ТФС, приводит к образованию наночастиц SiO2, и фурфурилового спирта, который заполняет матрицу и формирует сетчатый полимер. Эти частицы действуют как центры кристаллизации и зародышеобразования. Добавление ТФС увеличивает механическую и химическую стойкость связующего, и этот подход начал широко использоваться для подготовки кислотоупорных бетонов и шпатлевок [90,111].
Для повышения прочности, кислото-, термо- и огнестойкости строительных материалов и конструкций из них в состав связующего вводятся тетрафурфуриловые сложные эфиры ортокремневой кислоты (тетрафурфурилоксисиланы – ТФС). Они синтезируются путем переэтерификации тетраэтоксисилана фурфуриловым спиртом.
Состав получаемого связующего содержит: жидкое стекло – 80-95 мас.%, тетрафурфурилоксисилан (ТФС) – 2-7 мас.%, отвердитель, гексафторсиликат натрия – 13 мас.%. При этом как часть жидкого стекла используется органическое щелочное жидкое стекло, где в качестве органического катиона берется 8-диазабициклоундецен-7 или 1,5-диазабициклононен-5 - 2-4 мас.%.
Растворимый в воде силикат, содержащий органический щелочной катион, получают взаимодействием солей четверичного органического производного аммония с аморфным кремнеземом. Растворимые органические щелочные силикаты как, например, силикат тетрабутиламмония (ТБАС) используют как компонент для самозатухания связующего [89].
Предлагаемое наноструктурирующее связующее получают ламинарным смешиванием жидкого стекла, содержащего катионы щелочных металлов типа Na; тетрафурфурилового сложного эфира ортокремневой кислоты (ТФС) и растворимого в воде силиката, содержащего органический щелочной катион типа 1,8-диазабициклоундецена-7 (1,8-diazabicycloundecene-7) или 1,5-диазабициклононена-5.
После смешивания всех компонентов связующего его необходимо использовать в течение 2-3 часов. Добавление отвердителя осуществляется совместно с тонкомолотым минеральным наполнителем.
Введение в связующее наноструктурирующего компонента - тетрафурфурилового сложного эфира ортокремниевой кислоты приводит к образованию наночастиц SiO2, которые действуют как центры кристаллизации и зародышеобразования, и фурфурилового спирта, который заполняет кремнекислую матрицу и формирует сетчатый полимер. Добавление ТФС увеличивает механическую и химическую стойкость связующего и широко используется для подготовки кислотоупорных бетонов и шпатлевок. Жидкое стекло с катионом 1,4-диазабицикло[2.2.2]октана, совместимо с водными дисперсиями хлоропренов и полиуретанов, а также с большинством латексов на основе синтетических каучуков.
3.3. Синтез нанофазы в структуре матрицы композита
Введение углеродных материалов в качестве добавок в золь-гель процесс получения нанокомпозитов (см. рис. 4) представляет интерес как для модификации функциональных свойств нанокомпозита, так и в качестве своеобразного порообразующего компонента. Порообразующими компонентами называют вещества, исчезающие на различных стадиях формирования и обработки материалов с образованием пор. Углеродные материалы в процессе отжига в кислородсодержащей атмосфере превращаются в газообразные продукты. Возможность контролировать наноразмеры вводимых объектов из углеродных материалов предопределяет перспективность их использования для получения структур с заданными размерами пор [118].
Для таких технологических методов также используется термин "темплатный синтез", а вводимые частицы темплатами или шаблонами. Новые материалы с узким распределением пор по размерам необходимы для создания полупроводниковых газочувствительных сенсорных устройств нового поколения, композиционных мембран, сорбентов хроматографии и др.
Особо выделим роль пористых материалов, получаемых золь-гель методом, при разработке технологических операций нанесения диэлектрических покрытий с низкими значениями относительной диэлектрической проницаемости в микро и наноэлектронике [119].
На современном этапе развития кремниевой наноэлектроники значение сопротивления материалов стремятся снизить путем замены традиционного проводящего материала Al на Cu (или Cu в оболочке TiO2), а для снижения значения емкости интенсивно развиваются исследования по материалам с низкими эффективными значениями относительной диэлектрической проницаемости [120]. Одним из основных технологических приемов снижения усредненного значения диэлектрической проницаемости является формирование изолирующего слоя с нанопорами золь-гель методом.
Другим перспективным технологическим направлением является формирование на пористой структуре системы каталитически активных наночастиц. Использование таких подложек обеспечивает получение "нанотравы" из кремниевых или гетероструктурных нанопроводов [121,122], на основе которых изготавливаются приборы наноэлектроники, нанооптоэлекроники [123], сенсорной техники [124] и фотоники на нанопроводах [135]. К настоящему времени разработаны технологии получения гетероструктурных нанопроволок (нанонитей) с изменением состава как вдоль оси роста (аксиальные нанопроволочные гетероструктуры), так и в радиальном направлении (радиальные нанопроволочные гетероструктуры). В обзоре [123] обобщены данные о таких структурах на полупроводниковых соединениях A3B5, А2В6 и твердых растворов на их основе. В качестве катализатора, как правило, применяются наночастицы Au, а рост нанонитей происходит по механизму "пар-жидкость-кристалл".
4. ВЛИЯНИЕ РАЗЛИЧНЫХ ФАКТОРОВ НА СТРУКТУРУ И СВОЙСТВА ГИБРИДНЫХ МАТЕРИАЛОВ
4.1. Упаковка сферических наночастиц наполнителя
Система пор в твердом теле всецело определяется характером упаковки первичных частиц. Так, например, при плотневшей гексагональной упаковке сферических частиц между расположенными в плоскости ближайшими тремя тетраэдрическими пустотами находится октаэдрическая пустота. При последующих наслоениях над октаэдрической пустотой возникает снова октаэдрическая пустота. Накрадывающиеся друг на друга октаэдрические пустоты образуют каналы, пронизывающие все тело вещества во взаимно перпендикулярных направлениях [136].
В кубических структурах плотнейшей упаковки можно также указать на образование взаимосвязанных каналов. В упаковках данного типа объем пустот составляет 25,95 %. Отсюда можно рассчитать объемную массу материала (ρ):
![]()
где ![]() — кристаллографическая плотность материала, используемого в качестве основы.
— кристаллографическая плотность материала, используемого в качестве основы.
L — доля пустот в структуре упаковки.
Если наиболее легкие среди огнеупорных материалов имеют кристаллографические плотности, близкие к 3 г/см3, то объемная масса продукта с плотнейшей упаковкой составит 2,2 г/см3. Отсюда для получения материалов с объемной массой меньшей 0,5 г/см3, необходимо добиться пористости большей 83 %.
Попытаемся проанализировать, в каких системах упаковки можно достигнуть искомой пористости.
Обычно с уменьшением координационного числа упакованных частиц растет объем пор в них. В случае плотнейших упаковок координационное число упаковки равно 12. Рассмотрим следующие варианты координационных чисел упаковки. Классически, плотность такой упаковки составляет 74%, соответственно пористость такой упаковки равна 26%. Для монодисперсных материалов более плотной упаковки не бывает.
Координационное число 8. Кубическая объёмно-центрированная упаковка. В отличие от плотных упаковок она имеет рыхлую структуру. Здесь шары в плоском слое не соприкасаются друг с другом, а находятся на расстоянии 0,155R, Мотив постройки данной структуры характеризуется тем, что шары второго слоя опушены в пустоты нижележащего слоя. Третий слой повторяет первый, а четвертый — второй и т.д. Такой тип упаковки представляет свой оптимальный вариант пространственного расположения шаров с координационным числом 8 и обладает более низким процентом заполнения ее объема. Объем пор составляет 31,98 %.
Координационное число 6. Простая кубическая упаковка. Глобулярные структуры с координационным числом 6 построены путем последовательного наложения шаров, упакованных по квадратной сетке так, что центры шаров второго слоя располагаются строго над центрами шаров первого, третьего — над центрами второго и т.д. Пора в такой упаковке заключена между восьмью контактирующими шарами и имеет шесть горл, близких по форме к четырехугольным. При этом образуется более рыхлая структура, в которой объем пор составляет 47,64%,Координационное число 4. Упаковка типа алмаза и льда. Данная упаковка наибо-лее рыхлая из всех рассмотренных. Построена она из слоев шаров, раздвинутых друг от друга в плоскости. Шары следующего слоя находятся между шарами первого слоя. Центры шаров третьего слоя расположены строго над центрами шаров второго. Четвертый слой расположен точно над первым и т.д. В результате такой упаковки объем пустот составляет 65,99 %. В пределе (с уменьшением координационного числа) каждая симметрично построенная структура с заранее определенной системой пор должна перейти в хаотично сложенное тело с набором пор различных как по форме, так и по размеру. Границей такого перехода можно считать упаковку с координационным числом 3.
Координационное число 3. Данная упаковка представляет собой очень ажурные, рыхлые образования с непрерывным трехмерным каркасом. Пористость этой структуры составляет 81,5 %. Таким образом, опираясь только на различные виды упаковки сферических частиц, не удается достигнуть требуемой пористости, и тем более достичь плотности менее 0,2 г/см3.
Однако, если допустить образование смешанной упаковки с координационным числом 2 и 3, то есть, когда некоторые частицы в рассматриваемой упаковке присутствуют в виде коротких цепочек, состоящих минимум из трек частиц. Для таких упаковок можно достичь пористости - 95 %. Зависимость пористости от координационного числа при различных способах укладки сфер представлена на рис. 13, откуда видно, что пористость обратно пропорциональна величина координатного числа.
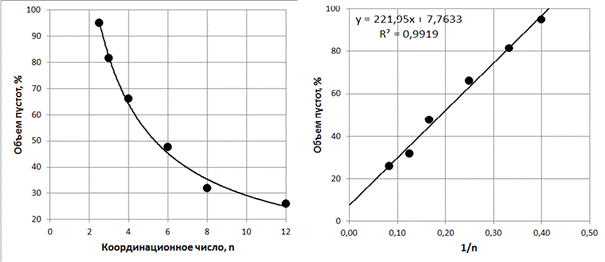
Рис. 13. Зависимость пористости упаковки сферических частиц от координационного числа n и 1/n.
В настоящее время материалы, в которых на долю пор приходится большая часть их объема, встречаются довольно часто, особенно различных сорбентов. Так, например, пористость силикагелей варьируется от 36 до 84 % [152,153]. Впервые в 1931 Kistler S.S. в журнале «The Journal of Physical Chemistry» описал приготовление сверхлегкого аэрогеля с пористостью 99 %. Пористость аэросилов достигает 95-98 % [137]. Аналогичные структуры формируются при диспергировании с помощью ПАВ волокнистых кристаллических силикатов типа хризотила. Образующиеся при этом отдельные волокна трубчатого типа с диаметром 18 мкм, вследствие переплетения создают очень рыхлые устойчивые коллоидные дисперсии с высоким значением пористости [157]. По-видимому, подобное сетчатое строение имеют лиогели, аэросилы и некоторые, особенно рыхло-упакованные, ксерогели, глобулярные цепочки которых связаны между собой так, что их число контактов для большинства глобул равно 2. Для придания жесткости скелету геля, число соприкосновений частиц с соседними, в узлах такой сетки, должно быть равно 3. Но в любом случае, такие структуры, построенные на основе сферических частиц, не будут обладать достаточной жесткостью.
Поэтому наиболее перспективным способам получения пористых материалов является применение различных волокон. Исходя из графика зависимости пористости α (%) от координационного числа n сферических частиц, приведенного на рис. 13, можно получить следующую зависимость:
![]()
Коэффициенты в этом уравнении имеют следующие значения: α∞=7,7633; B=221,95, R2=0,9958. Поскольку уравнение этой кривой имеет особую точку, то можно рассчитать предельное значение координационного числа, при котором объем пустот будет равен 100%. Величина n0=2,398±0,008. Физический смысл этой величины заключается в том, что в структурах дисперсных наносистем при координационном числе меньше этой величины отсутствует сколько-нибудь жесткая структура каркаса материала собранного из отдельных наночастиц, или они собираются только в цепочечные структуры, в которых реализуется координационное число 2.
В последние десятилетия бурное развитие вычислительной техники привело к созданию принципиально нового мощного средства исследования физических процессов – вычислительного эксперимента. В условиях, когда теоретические методы наталкиваются на серьезные трудности, а практические эксперименты либо чрезмерно трудоемки, либо принципиально невозможны, численное моделирование оказывается единственным способом изучения рассматриваемых процессов. Создание компьютерных моделей стало в настоящее время признанным и быстро развивающимся направлением в науке и технике. Применение моделирования по сравнению с традиционными лабораторными методами экономит средства и время работы. В исследованиях, основанных на вычислительных экспериментах, решающую роль играет представление физического явления в виде соответствующей математической модели, вычислительного алгоритма, компьютерной программы. Математическая модель в вычислительном эксперименте является одновременно исследуемым материалом и алгоритмом его проведения. В работе [138] показано, что одним из широко распространенных методов построения математических моделей является моделирование с помощью частиц, или метода частиц.
Указывается также, что при правильном использовании метод частиц в состоянии продемонстрировать свои явные преимущества. На основе накопленного теоретического и экспериментального материала [138-140] построена компьютерная модель дисперсных систем, основанная на методе частиц.
Метод частиц является общим для класса моделей, в которых дискретное описание физических явлений включает рассмотрение взаимодействующих частиц. Любую классическую систему можно описать, зная положения и скорости частиц, которые ее составляют, и закон их взаимодействия. Каждая частица имеет ряд сохраняющихся характеристик (например, массу и размер) и меняющихся характеристик (например, положение и скорость).
В качестве объекта численного исследования дисперсных систем методом компьютерного моделирования был выбран порошок алюминия. Это обусловлено тем, что частицы алюминия имеют сферическую форму. В результате проведенных вычислений были получены различные степени объемного наполнения под действием сжимающей силы. Из представленных на рис. 14 данных распределения координационных чисел для различных объемных наполнений порошка следует, что предельное объемное наполнение порошка, равное 64%, соответствует состоянию, когда более чем 40% частиц имеет координационное число 12.
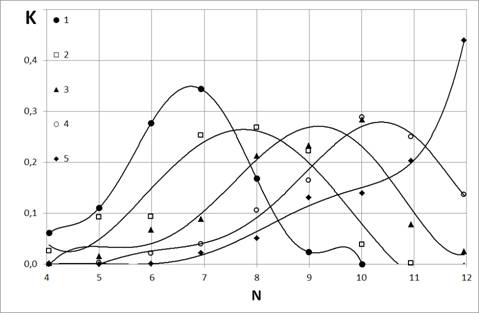
Рис. 14. Распределения координационных чисел для различных объемных наполнений порошка: 1 – 0.56; 2 – 0.58; 3 – 0.60; 4 – 0.62; 5 – 0.64.
Компьютерная модель также дает возможность изучать природу контактов между частицами в дисперсной системе. Были проведены вычислительные эксперименты по исследованию расстояния между "контактирующими частицами". На рис. 15 представлены распределения числа парных контактов в зависимости от расстояния между частицами для различных объемных наполнений. Из рисунка следует, что для всех объемных наполнений зависимость распределения парных контактов частиц от расстояния между ними имеет два максимума. Уменьшение объемного наполнения системы приводит к смещению максимумов в область большего расстояния между частицами.
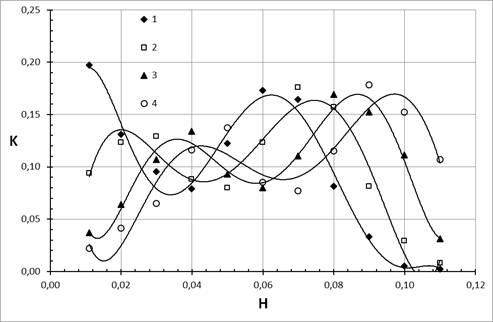
Рис. 15. Распределения парных контактов частиц в зависимости от расстояния между ними для различных объемных наполнений системы: 1 – 0.64; 2 – 0.62; 3 – 0.60; 4 – 0.56
Хранение и переработка порошка в реальных условиях сопровождается поглощением им влаги из окружающей среды в результате адсорбции паров воды на поверхности частиц и ее капиллярной конденсации в порах материала. Образование жидкой фазы приводит к появлению жидких "мостиков" и капиллярных сил между частицами порошкообразного материала. Эти силы оказывают существенное влияние на поведение и свойства порошков и дисперсных композиций как при хранении, так и при использовании в технологических процессах. При этом значительное влияние на величину сил оказывают различные параметры частиц, и, в частности, их размеры и форма, обуславливающие тип "контакта" частиц. Следовательно, определение влияния геометрических параметров частиц порошка на величину капиллярных сил, действующих между ними, позволит полнее прогнозировать свойства и поведение порошкообразных компонентов, а также будет способствовать получению на их основе дисперсных материалов с заданными свойствами.Предложенный метод позволяет также определить количество жидкости в капиллярных "мостиках" между частицами и величину капиллярного давления как параметра, определяющего одну из составляющих капиллярных сил [141]. В качестве расчетной ячейки было рассмотрено капиллярное взаимодействие двух соединенных жидким "мостиком" частиц, имеющих формы сферы, конуса и плоскости. Значительное число различных типов "контакта" частиц в реальных дисперсных системах может быть описано с помощью выбранных форм.
Величина капиллярной силы при этом, как и в случае сферических частиц одинакового размера, зависит от двух составляющих. Первая определяется поверхностным натяжением жидкости, действующим по периметру смачивания. Вторая составляющая обусловлена наличием в жидкости разряжения или давления, описываемого уравнением Лапласа и возникающего вследствие искривления поверхности "мостика".
Видно, что во всех случаях рост количества жидкости сопровождается появлением максимума капиллярных сил. Увеличение капиллярных сил происходит и с ростом отношения размеров частиц (рис. 16), сопровождающимся также приближением величин сил к значениям, соответствующим "контакту" частиц типа "сфера-плоскость". Однако с ростом отношения размеров частиц, наблюдается снижение его влияния на капиллярные силы, особенно при больших объемах жидкого "мостика", когда различия в величинах сил становятся незначительными. На основании полученных данных было не только качественно подтверждено, но и количественно показано влияние различия в размерах частиц на величину капиллярных сил, действующих между ними.
Рис. 16. Зависимость капиллярной силы от объема жидкого "мостика" при взаимодействии частиц типа "сфера-сфера". Радиус частицы равен 5 мкм. Отношение радиусов частиц равно: 1 – 100, 2 – 10, 3 – 5, 4 – 2.5, 5 – 1.
С помощью полученных уравнений были определены зависимости капиллярных сил от количества жидкости в "мостике" для рассмотренных типов "контакта" частиц (рис. 17). В качестве капиллярной жидкости рассматривалась вода. Для всех типов "контакта" величина зазора между частицами равнялась 0.01 мкм, угол смачивания составлял 0°. Из рис. 17 видно, что тип "контакта" частиц оказывает существенное влияние на величину капиллярной силы. Его влияние возрастает с увеличением объема "мостика".
Рис. 17. Зависимость капиллярной силы от объема жидкого "мостика" для различных типов "контакта" частиц: 1 – "плоскость-плоскость" (d = 0.2 мкм), 2 – "сфера-плоскость" (R = 0.5 мкм), 3 – "сфера-сфера" (R1 = R2 = 0.5 мкм), 4 – "конус-конус" (β1 = β2 = 150°), 5 – "конус-плоскость" (β = 90°), 6 – "конус-конус" (β1 = β2 = 90°).
На основе предложенных моделей были описаны и экспериментально проверены реологические свойства органо-минеральных нанодисперсий и возможности получения на их основе токопроводящих полимерных композитов [142,143].
4.2. Упаковка волокнистых наночастиц наполнителя
Неоднородная структура является одним из важнейших факторов, предопределяющих механическое поведения армированных, дисперсно-упрочненных нанокомпозитов при нагружении. В настоящее время существует потребность моделирования пространственных структур нанокомпозитов с целью прогнозирования их эффективных упругих и прочностных характеристик. Исключение возможности получения слабопредсказуемых результатов особенно актуально для задач генерации материалов с высокими объемными долями волокон, достижение которых становится возможным благодаря использованию специально сконструированных итерационных процедур упорядочения армирующих элементов.
Синтез фрагментов случайной структуры волокнистых нанокомпозитов, армирующими элементами для которых являются круглые в поперечном сечении волокна, связан со случайным размещением непересекающихся гладких дисков на плоскости. В работах [144,145] подробно описаны различные способы генерации волокнистых и дисперсно-упрочненных материалов. Для определения закономерностей образования разреженных и плотноупакованных структур армированных нанокомпозитов, и оценки влияния факторов влияющих на их свойства, были реализованы следующие алгоритмы.
Алгоритм 1 (метод статистических испытаний). В исследуемом фрагменте (как правило, единичном квадрате), случайным образом размещается волокно. Если сгенерированное волокно не выходит за границы фрагмента, то координаты его центра фиксируются. При синтезе следующих волокон производится проверка пересечения с ранее размещенными волоками. В случае одновременного выполнения двух условий: отсутствия пересечений со всеми армирующими элементами и принадлежности исследуемому фрагменту сгенерированное волокно «включается» в структуру композита. При достижении необходимой или максимально возможной объемной доли, а также до выполнения условия превышения числом неудачных попыток размещения армирующих элементов предельного значения.
Алгоритм 2 (дополнительное смещение волокон при «жестких» границах фрагмента). Этот алгоритм является модификацией метода «радиального гравитационного поля», особенности программной реализации которого подробно описаны в работе [144]. Синтез случайной структуры осуществляется дополнительным взаимным перемещением вдоль прямой, соединяющей центры поперечных сечений, вновь и ранее сгенерированных волокон на расстояние, гарантирующее отсутствие пересечений со всеми структурными элементами. Полностью исключается выход какой-либо части поперечного сечения армирующего элемента за границы области: если в процессе коррекции размещения какое-либо волокно соприкасается с границей фрагмента, то его перемещение возможно только вдоль этой границы. Генерация волокон и модификация их расположения производятся до создания случайной структуры с заданным объемным наполнением или достижения числом дополнительно перемещаемых волокон некоторого предельного значения.
Важной характеристикой случайной структуры композитов является объемная доля армирующего наполнителя. Для определения предельной объемной доли волокон необходимо выбрать параметр, в качестве которого для алгоритма 1 может быть использовано общее количество неудачных попыток размещения волокна, а для алгоритма 2 – относительное число дополнительно перемещаемых волокон (нормировка осуществляется к общему количеству волокон) в сгенерированной структуре композита. Выход зависимостей объемной доли от этих параметров (рис. 18) на горизонтальные асимптоты соответствует моменту достижения предельного объемного наполнения при заданной относительной толщине гарантированной прослойки матрицы d/R (R — радиус волокна), окружающей каждое волокно.
Рис. 18, Зависимость объемного наполнения композита от относительного числа дополнительно перемещаемых волокон. Толщина гарантированной прослойки матрицы d/R составляет; 1 – 0,0; 2 – 0,1; 3 – 0,3; 4 – 0,6 и 5 – 1,0 [145].
В табл. 1 представлены полученные в результате осреднения по 20 независимым реализациям случайной структуры композитов предельные объемные доли круглых в поперечном сечении волокон одинакового диаметра, окруженных прослойками материала матрицы различной толщины. Размер гарантированной прослойки матрицы является параметром, зависящим от природы компонентов нанокомпозита, технологии получения материала, состава и свойств специальных покрытий и адгезионных композиций, наносимых на армирующий наполнитель в процессе изготовления композита, от параметров двойного электрического слоя или характера ван-дер-ваальсовых сил. Как видим, увеличение толщины гарантированной прослойки до размера, соответствующего радиусу волокна, приводит к снижению более чем в два раза предельной объемной доли.
Таблица 1
Предельные объемные доли ![]() круглых в поперечном сечении волокон
круглых в поперечном сечении волокон
Гарантированная прослойка матрицы d/R |
0.00 |
0.10 |
0.20 |
0.30 |
0.40 |
0.50 |
0.60 |
0.70 |
0.80 |
0.90 |
1.00 |
Алгоритм 1 |
0.53 |
0.48 |
0.44 |
0.40 |
0.37 |
0.34 |
0.31 |
0.29 |
0.27 |
0.25 |
0.24 |
Алгоритм 2 |
0.80 |
0.73 |
0.66 |
0.61 |
0.55 |
0.51 |
0.48 |
0.45 |
0.42 |
0.40 |
0.37 |
В реальных композитах объемная доля армирующего наполнителя, как правило, составляет 0,60-0,70, а в высоконаполненных материалах – до 0,80-0,85. Для получения фрагментов случайной структуры с объемным наполнением, превышающим vf = 0,50, был использован алгоритм 2, в рамках которого предусмотрена итерационная процедура дополнительного смещения волокон. Было обнаружено, что значение ![]() = 0,80 (волокна одинакового поперечного сечения без гарантированной прослойки) превосходит максимально возможную степень наполнения композита с периодическим расположением волокон в узлах тетрагональной сетки (
= 0,80 (волокна одинакового поперечного сечения без гарантированной прослойки) превосходит максимально возможную степень наполнения композита с периодическим расположением волокон в узлах тетрагональной сетки (![]() = 0,785), но не достигает предельной объемной доли для материала с периодической гексагональной структурой (
= 0,785), но не достигает предельной объемной доли для материала с периодической гексагональной структурой (![]() = 0,907). Регистрируемая величина
= 0,907). Регистрируемая величина ![]() совпадает со значением предельного наполнения для случайных плотных упаковок из «гладких» непересекающихся дисков одинакового диаметра, полученным авторами [146].
совпадает со значением предельного наполнения для случайных плотных упаковок из «гладких» непересекающихся дисков одинакового диаметра, полученным авторами [146].
В этих работах были представлены данные, прежде всего для материалов с высоким наполнением, что особенно важно для конструкционных материалов. Однако для нанокомпозитов большое значение имеют также низкие степени наполнения волокнами. Подобный расчет был представлен в работе [63].
Проводя аналогию между упаковкой сфер, описанной в разделе 4.1., и волокон можно представить следующую аналогию между ажурной упаковкой сферических частиц и упаковкой волокон. Если цепочку скрепленных сфер представить в виде описанных вокруг них цилиндров, то можно построить связь между средним координационным числом у сфер в данной структуре и соотношением диаметра волокна dv и среднего расстояния между точками контакта двух соседних однонаправленных волокон, пересекающихся и касающихся третьего волокна lср. При n=3, lср=2rs=dv где dv—диаметр волокна, а при n=2, lср=![]()
Следовательно, эффективное координационное число равно:
![]()
Отсюда:
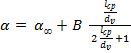
Обработка зависимости на рис. 1.2.2.1 методом наименьших квадратов и с учетом поправки на отличие волокон от цепочки сфер дало следующие значения постоянный коэффициентов ![]() и B:
и B:
![]() ;
; ![]()
Из этой зависимости видно, что уже при отношении lcp/d равном 5 достигается 95 % пористости.
4.3. Наноматериалы на основе слоистых частиц
В настоящее время такие композиты достаточно широко применяются в промышленности, как в качестве конструкционных материалов, так и в других целях. Добавление в полимер даже малых порций (обычно 3-5 масс.%) силикатных нанопластинок позволяет значительно улучшить барьерные диффундирующие свойства материала, термическую стабильность, устойчивость к тепловому короблению [148-152]. Связано это, скорее всего с тем, что в отличие от обычных композитов (их отдель-ные компоненты имеют микронные и субмикронные размеры) для наноматериалов характерна чрезвычайно высокая площадь межфазных границ, в результате чего их роль в формировании физических свойств материала становится определяющей. Это позволяет получить значительный выигрыш в улучшении тех или иных физических характеристик наноматериала при весьма незначительных концентрациях наполнителя. В нанокомпозитах объемная доля частиц составляет обычно всего несколько процентов, тогда как в обычных композитах она на порядок выше [153].
Впервые использовать сверхмелкий глинистый наполнитель было предложено Shepherd P.D. и др. еще в 1974 г., но только недавно, такие материалы стали пользоваться действительно широким спросом. В настоящее время одним из наиболее распространенных типов нанокомпозитов являются системы на основе полиолефинов и слоистых глинистых минералов (смектитов). В прошедшие десятилетия во всем мире наблюдался стремительный рост количества публикаций и патентов, касающихся процесса их изготовления и изучения механических свойств [151,155,157]. Для таких систем удалось добиться существенного увеличения упругого модуля, прочности, огнестойкости, стойкости к тепловому короблению, улучшения барьерных свойств по отношению к диффундирующим веществам. Однако анализ известных публикаций показывает, что эта отрасль материаловедения с точки зрения осмысления и объяснения наработанного фактического материала разработана еще явно недостаточно.
В качестве матрицы использовали такой широко распространенный полимер, как полиэтилен. Это частично кристаллизующийся материал, и даже в чистом виде имеет сложную многоуровневую иерархическую структуру, то есть хорошо выраженную структурную неоднородность на нано-, мезо- и микроуровне [155].
Рассматриваемые системы представляют собой структурно-неоднородную среду, состоящую из полиолефиновой матрицы и внедренных в нее ультратонких силикатных чешуек толщиной в несколько нанометров и характерным диаметром от десятков нанометров до 1 мкм в зависимости от месторождения минерала и условий его формирова-ния. Характерные размеры частиц наполнителя составляют 1-2 нм по толщине и от 30 до 1000 нм в диаметре. Эти частицы могут хаотично распределяться по объему материала или образовывать отдельные пачки – тактоиды – из нескольких (порядка десятков) параллельно расположенных пластинок, между которыми располагаются одна или несколько молекул матричного полимера [152]. В первом случае нанокомпозиты называются эксфолиированными, во втором – интеркалированными.
При низкой термодинамической совместимости наполнителя и матрицы молекулы полимера не могут проникнуть в промежутки между слоями силиката. Получающийся в данном случае материал представляет собой просто механическую смесь полимера и минерала – это обычный дисперсно наполненный микрокомпозит [158]. При формировании интеркалированного нанокомпозита молекулы полимера диффундируют в пpостpанство между близко расположенными параллельными силикатными пластинками. В результате происходит разбухание кристаллита, но без потери порядка в расположении его слоев. При образовании эксфолиированного нанокомпозита молекулы полимера не только проникают в зазоры между слоями тактоида, но и раздвигают их до такой степени, что происходит его разрушение, и ранее параллельные силикатные пластинки приобретают [69,147].
Когда образуется расслоенный нанокомпозит, полимерные молекулы не только проникают в пространство между слоями тактоидов, они вынуждают их взаимодействовать друг с другом, таким образом, что эта структура разрушается, и параллельные силикатные пластинки теряют свою ориентацию и распределяются случайным образом в объеме материала. Рисунок 19 представляет собой схематическое представление структуры нанокомпозита в случаях интеркалированного и расслоенного наполнителя [151].
Рис. 19 Схематическое представление различных структурных типов нанокомпозитов полимер/глина: (a) кристаллит глины (tactoid), (b) исходный полимер, (c) интеркалированный нанокомпозит, (d) расслоенный нанокомпозит, (e) фазоразделенный нанокомпозит.
Прочностные свойства нанокомпозита улучшаются, если частицы силикатного наполнителя ориентированы вдоль направления внешней деформации (за счет улучшения адгезии между матрицей и включениями вследствие «закусывания» матрицы при загибе внешних пластинок внутрь и отсутствия изгибов у внутренних пластинок), что может быть достигнуто при предварительной обработке материала, например, волочением через фильеру или другими аналогичными способами.
Концентрация наполнителя в большей степени сказывается на возрастании макромодуля. При наполнении всего 6-8% модуль увеличивается примерно в 3 раза, тогда как для композитов с зернистым наполнителем известная формула Эйнштейна дает увеличение модуля лишь в 1,2 раза [155].
Заключение
Синтез и изучение свойств новых органоминеральных гибридных нанокомпозитов имеет большое значение. На основе таких исследований могут быть найдены методы решения многих конкретных технологических задач. Перспективными направлениями в области органоминеральных гибридных нанокомпозиционных материалов станут методы синтеза мультикомпонентных материалов, а также типа «сетка в сетке» и «гость-хозяин». Перспективны пути использования алкоголятов различных металлов, в том числе сложных многоядерных и порлифункциональных, в золь-гель процессах. Фундаментальной проблемой химии и физики нанокомпозитов остается зависимость «структура-свойство». Решение этой проблемы позволит перейти от исследований материалов к их целенаправленному проектированию. Эта задача во всем мире заставляет активно работать различных специалистов над ее решением.
Литература:
1. Кербер М.Л., Полимерные композиционные материалы. Структура. Свойства. Технологии. – СПб.: Профессия (2008). – 560 с.
2. Friedrich K., Fakirov S., Zhang Z. Polymer composites: from nano-to-macro-scale (2005), Springer.
3. Кобаяси Н. Введение в нанотехнологию. - М.:БИНОМ (2005). – 134с.
4. KajiwaraY., Chujo Y. Microwave-enhanced hybridizations of biopolymers with silica: effective method for rapid preparation and homogeneous dispersion, Polymer Bulletin (2011), Vol. 66, 8, pp. 1039-1050.
5. Kickelbick, G. Introduction to Hybrid Materials, in Hybrid Materials: Synthesis, Characterization, and Applications (ed G. Kickelbick), Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany (2007). doi: 10.1002/9783527610495.ch1
6. Pomogailo A.D. Hybrid polymer-inorganic nanocomposites. Russian Chemical Reviews. (2000), Vol. 69. № 1. С. 53-80..
7. Помогайло А.Д., Розенберг А.С., Уфлянд И.Е. Наночастицы металлов в полимерах, М.: «Химия» (2000).
8. Guglielmi M., Kickelbick G., Martucci A. (Eds.), Sol-Gel Nanocomposites, Series: Advances in Sol-Gel Derived Materials and Technologies (2014), IX, 227 p.
9. Hench L.L., West J.K. The sol-gel process, Chem. Rev. (1990), 90, 1, pp. 33-72, DOI: 10.1021/cr00099a003.
10. Сергеев Г.Б. Нанохимия, М.: Издательство МГУ (2003).
11. Segal, D.L. Chemical Preparation of Powders. Materials Science and Technology (2006).
12. Hirano S. Hydrothermal processing of ceramics. Am. Ceram. Soc. Bull. (1987), 66, 9, pp.1342–1344
13. Somiya S., Roy R. Hydrothermal synthesis of fine oxide powders. Bull. Mater. Sci. (2000), 23, 6, p. 453-460. doi:10.1007/BF02903883
14. Lakeman C.D.E., Payne D.A. Sol-gel processing of electrical and magnetic ceramics. Mater Chem Phys (1994), 38, 4, p.305–324. doi:10.1016/0254-0584(94)90207-0
15. Livage J., Beteille F., Roux C., Chatry M., Davidson P. Sol-gel synthesis of oxide materials. Acta. Mater. (1998), 46, 3, pp.743–750. doi:10.1016/S1359-6454(97)00255-3
16. Komarneni S., Abothu I.R., Rao A.V.P. Sol-gel processing of some electroceramic powders. J Sol-Gel Sci. Technol. (1999), 15, 3, pp.263-270
17. Lee G.R., Crayston J.A. Sol-gel processing of transition-metal alkoxides for electronics. Adv. Mater. (Weinheim, Fed Repub Ger) (1993), 5, 6, 434-442. doi:10.1002/adma.19930050604
18. Sakka S. Sol-gel coating films for optical and electronic application. Struct Bonding (Berlin) 85(Optical and electronic phenomena in sol-gel glasses and modern application) (1996), 1-49
19. Levy D., Esquivias L. Sol-gel processing of optical and electrooptical materials. Adv Mater (Weinheim, Ger), (1995), 7, 2, pp.120-129. doi:10.1002/adma.19950070204
20. Brinker C.J., Scherer G.W. Sol-gel science: the physics and chemistry of sol-gel processing. Access online via Elsevier (1990).
21. Dimitriev Y. Ivanova Y. Iordanova R. History of sol-gel science and technology (review). J. Univ. Chem. Technol. Metall. (2008), 43, pp.181-192
22. Livage J., Henry M., Sanchez C. Sol-gel chemistry of transition metal oxides. Prog. Solid State. (1988), 18, 4, pp. 259-341. doi:10.1016/0079-6786(88)90005-2
23. Nemeth S. Processing and mechanical properties of hybrid sol-gel-derived nanocomposite coatings. CRC Press, Boca Raton (2010), pp. 147-204
24. Glaubitt W., Loebmann P. Antireflective coatings prepared by sol-gel processing: principles and applications. J Eur Ceram Soc. (2012), 32(11), p.2995-2999. doi:10.1016/j.jeurceramsoc.2012.02.032
25. Cushing B..L, Kolesnichenko V.L, O’Connor C.J. Recent advances in the liquid-phase syntheses of inorganic nanoparticles. Chem. Rev. (Washington, DC, U S), (2004), 104, 9, pp.3893-3946. doi:10.1021/cr030027b
26. Niederberger M. Nonaqueous sol-gel routes to metal oxide nanoparticles. Acc Chem Res. (2007), 40(9):793-800. doi:10.1021/ar600035e
27. Sanchez C., Rozes L., Ribot F., Laberty-Robert C., Grosso D., Sassoye C., Boissiere C., Nicole L. ‘‘Chimie douce’’: a land of opportunities for the designed construction of functional inorganic and hybrid organic-inorganic nanomaterials. C.R.Chim., (2010), 13, 1–2, pp.3-39. doi:10.1016/j.crci.2009.06.001
28. Kickelbick G. (Editor). Hybrid Materials: Synthesis, Characterization, and Applications, (2007), Wiley, 516 p.
29. Amphlett C.B. Inorganic ion exchangers, Elsevier, Amsterdam, (1964).
30. Tanabe K. Solid Acids and basis. Their catalytic properties, Kodansha, Tokyo, (1970).
31. Smith M.B. March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 7th Edition, (2013), 2080 p.
32. Pomogailo A.D. Polymer sol-gel synthesis of hybrid nanocomposites, Colloid Journal. (2005), Vol. 67. № 6. pp. 658-677.
33. Hay J.N., Raval H.M. Synthesis of organic-inorganic hybrids via the nonhydrolytic solgel process. Chem. Mater., (2001), 13(10), pp.3396-3403. doi:10.1021/cm011024n
34. Loy D.A., Shea K.J. Bridged polysilsesquioxanes. Highly porous hybrid organic-inorganic materials. Chem Rev (Washington, D C), (1995), 95(5), pp.1431–1442. doi:10.1021/cr00037a013
35. Aegerter M.A. Leventis N. Koebel M.M. eds. Aerogels handbook, Springer, (2011), 965 p.
36. Фиговский О.Л., Кудрявцев П.Г. Жидкое стекло и водные растворы силикатов, как перспективная основа технологических процессов получения новых нанокомпозиционных материалов, "Инженерный вестик Дона", №2, (2014).
37. HayJ.N., Adeogun M., Raval H. “Sol-gel Hybrids: Hydrolyze or Not”. (2000).
38. Bourya B., Corriua R.J.P., Delordb P., Structure of silica-based organic–inorganic hybrid xerogel, J.Non-Cryst. Solids, Vol. 265, 1–2, (2000), pp. 41–50
39. Bourget L., Corriu R.J.P., Leclercq D., Mutin P.H., Vioux A. Non-hydrolytic sol–gel routes to silica, J. Non-Cryst. Solids, Vol. 242, 2–3, (1998), pp. 81–91.
40. Andrianainarivelo M., Corriu R.J.P., Leclercq D., Mutin P.H., Vioux A. Nonhydrolytic Sol-Gel process: Aluminium and zirconium titanate gels, Journal of Sol-Gel Science and Technology, (1997), Volume 8, Issue 1-3, pp 89-93.
41. Anil K.P.S., Alias J.P., Date S.K. Effect of compositional homogeneity on the magnetic properties of La0.7Ca0.3MnO3. J. Mater. Chem., (1998), 8, 1219-1223, DOI: 10.1039/A708235E .
42. Hay J.N., Raval H.M. Preparation of Inorganic Oxides via a Non-Hydrolytic Sol-Gel Route, Journal of Sol-Gel Science and Technology, (1998), Vol. 13, Issue 1-3, pp 109-112.
43. Mutin P.H., Vioux F. Recent advances in the synthesis of inorganic materials via non-hydrolytic condensation and related low-temperature routes, J. Mater. Chem. A, (2013), 1, 11504-11512, DOI: 10.1039/C3TA12058A, Highlight
44. Debecker D.P., Mutin P.H. Non-hydrolytic sol–gel routes to heterogeneous catalysts , Chem. Soc. Rev., (2012), 41, pp. 3624-3650, DOI: 10.1039/C2CS15330K
45. Hay J., Raval H., Porter D. A non-hydrolytic route to organically-modified silica. Chem. Commun., (1999), 81-82, DOI: 10.1039/A807491G
46. Park M., Commarneni S., Choi J. Effect of substituted alkyl groups on textural properties of ORMOSILs. Journal of Materials Science, (1998), Vol. 33, 15, pp. 3817-3821.
47. Schmidt Р. New type of non-crystalline solids between inorganic and organic materials. J. Non-Cryst. Solids, (1985), Vol. 73, P. 681–691. DOI: 10.1016/0022-3093(85)90388-6
48. Iwamoto T., Mackenzie J.D. Hard ormosils prepared with ultrasonic irradiation. J. Sol-Gel Science and Technology, (1995), Vol. 4, 2, pp. 141-150.
49. Туторский И.А., Скловский М.Д. Межфазные явления в полимерных композитах. М.: ЦНИИТЭнефтехим, (1994), 100 с.
50. Айлер И. Химия кремнезема, т.1, М.: Мир, (1982), 416 с.
51. Hwang, S.-W.; Jung, H.-H.; Hyun, S.-H., Ahn, Y.-S., Effective preparation of crack-free silica aerogels via ambient drying, J. Sol-Gel Sci. Technol. (2007), 41, 139–146
52. Figovsky O., Beilin D., Advanced Polymer Concretes and Compounds@ CRC Press, Tailor &Francis Group, (2013), 245 p.
53. Корнеев В.И, Данилов В.В. Растворимое и жидкое стекло. Санкт-Петербург: Стройиздат, СПб., (1996).
54. Kudryavtsev P.G. Alkoxides of chemical elements - Promising class of chemical compounds which are raw materials for HI-TECH industries, Journal "Scientific Israel - Technological Advantages", Vol.16, no.2, (2014), p. 147-170.
55. Григорьев П.Н., Матвеев М.А. Растворимое стекло (получение, свойства и применение) – М., (1956).
56. Кудрявцев П.Г., Вольхин В.В. Золь-гель процессы и некоторые его технологические приложения, Золь-гель процессы получения неорганических материалов, тез. докл. семинара, Пермь, (1991), с.3-5.
57. Christophlienk P. Glastechn. Ber., (1985), 85, N 11, S. 308.
58. Vail J.G. Soluble silicates in industry, ISBN 978-5-8727-6991-0; (2011), 456 p.
59. Hoebbel, D., Garzó, G., Engelhardt, G., Ebert, R., Lippmaa, E. and Alla, M. Über die Silicatanionenkonstitution in Tetraethylammoniumsilicaten und ihren wäßrigen Lösungen. Z. anorg. allg. Chem., (1980), 465: 15–33. doi: 10.1002/zaac.19804650103
60. Hoebbel, D., Vargha, A., Engelhardt, G. and Ujszászy, K. Zum Anionenaufbau von Tetra-n-butylammoniumsilicaten und ihren wäßrigen Lösungen. Z. anorg. allg. Chem., (1984), 509: 85–94. doi: 10.1002/zaac.19845090209
61. Шульце В., Тишер В., Эттель В.П. Растворы и бетоны на нецементных вяжущих. М.: Стройиздат, (1990), 240 с.
62. Шевяков В.П., Жолудов В.С. Защита от коррозии промышленных зданий и сооружений, ТОО Редакция газеты Архитектура, Москва: (1995), 170 с.
63. Figovsky O., Kudryavtsev P. Advanced nanomaterials based on soluble silicates. Journal "Scientific Israel - Technological Advantages", Vol.16, no.3, (2014).
64. Борсук П. А., Лясс А. М. Жидкие самотвердеющие смеси. М.: Машииоcтроение, (1979), 255с.
65. Sears G.W. Determination of Specific Surface Area of Colloidal Silica by Titration with Sodium Hydroxide, Analytical Chemistry, (1956), 28, 12, pp.1981-1983.
66. . Кудрявцев П.Г., Кавалерова О.Б., Казакова И.Л., Вольхин В.В. Получение и стабилизация растворов оксидов металлов, Семинар: Золь-гель процессы получения неорганических материалов, Пермь, (1991), с.33.
67. Кудрявцев П.Г., Недугов А.Н., Рябов В.А., Волкова М.А., Кайсин А.В., Коротаев И.М., Коркин А.М. Патент РФ № 2388693, Способ получения алюмокремниевого флокулянта- коагулянта и способ очистки с его помощью воды, (2008).
68. Мелихов И. В., Меркулова М. С., Сокристаллизация, М., Наука, (1975).
69. Помогайло А.Д. Synthesis and Intercalation Chemistry of Hybrid Organo-Inorganic Nanocomposites, Высокомолекулярные соединения. 2006. Т. 48. № 7. С. 1317-1351.
70. Rosen M.J.. Surfactants and Interfacial Phenomena, 3ed., Wiley, (2004), 455p.
71. Фиговский О.Л., Бейлин Д.А., Пономарев А.Н. Успехи применения нанотехнологий в строительных материалах, Nanobuild, v.3, (2012), p.6-21.
72. Huusing N., Schubert U. Aerogels. In: Ullmann’s Encyclopedia of Industrial Chemistry, 6th edn. Wiley, (2002)
73. Rodembusch FS, Campo LF, Stefani V, Rigacci A The first silica aerogel fluorescent by excited state intramolecular proton transfer mechanism (ESIPT). J Mater Chem., (2005), 15, pp. 1537–1541
74. Smith D.M., Deshpande R., Brinker C.J. Preparation of low-density aerogels at ambient pressure. Mat. Res. Soc. Symp. Proc., (1992) Vol. 271 567–572
75. Kuhn J., Gleissner T., Aruini-Schuster M.C., Korder S., Fricke J. Integration of mineral powders into SiO2 aerogels. J. Non-Cryst. Solids, (1995), 186, pp.291–295
76. Santos A., Ajbary M., Toldeo-Fernandez J.A., Morales-Florez V., Kherbeche A., Esquivias L. Reactivity of CO2 traps in aerogel-wollastonite composite. J. Gel. Sci. Technol. (2008), 48, pp.224–230.
77. Kulkarni M.M., Bandyopadhyaya R., Bhattacharya B., Sharma A. Microstructural and mechanical properties of silica-PEPEG polymer composite xerogels. Acta Materialia, (2006), 54 pp. 5231–5240
78. Vicarini M.A., Nicolaon G.A., Teichner S.J. Proprie´te´s texturales d’ae´rogels mine´raux mixte pre´pare´s par hydrolyse simultane´e de deux alcoolates me´talliques en solution dans un milieu organique. Bulletin de la Socie´te´ Chimique de France, (1970), 10, pp.3384–3387
79. Cao S., Yao N., Yeung K.L. Synthesis of freestanding silica and titania-silica aerogels with ordered and disordered mesopores. J Sol-Gel Sci and Tech., (2008), 46, pp.323–333
80. Mosquera MJ, de los Santos DM, Valdez-Castro L, Esquivias L New route for producing crack-free xerogels: obtaining uniform pore size. J Non-Cryst Solids, (2008), 354, pp.645–650.
81. Meador M.A., Fabrizio E.F., Ilhan F., Dass A., Zhang G., Vassilarias P., Johnston J.C., Leventis N. Cross-linking amine-modified silica aerogels with epoxies : mechanically strong lightwight prorous materials. J.Chem. Mater., (2005), 17, pp.1085-1098
82. Patwardhan S.V., Mukherjee N., Durstock M.F., Chiang L.Y., Clarson S.J. Synthesis of C-60 fuellerenesilica hybrid nanostructures. Journal of Inorganic and Organometallic Polymers, (2002), 12, pp. 49–55
83. Morris C.A., Rolison D.R., Swider-Lyons K.E., Osburn-Atkinson E.J., Merzbacher C.I. Modifying nanoscale silica with itself: a method to control surface properties of silica aerogels independently of bulk structure. J. Non-Cryst. Solids, (2001), 285, pp. 29–36.
84. Wallace J.M., Rice J.K., Pietron J.J., Stroud R.M., Long J.W., Rolison D.R. Silica nanoarchitectures incorporating self-organized protein superstructures with gas-phase bioactivity. Nano Lett., (2003), 3, pp. 1463–1467.
85. Anderson M.L., Rolison D.R., Merzbacher C.I. Composite aerogels for sensing applications. Proc. SPIE. (1999), 3790, pp. 38–42.
86. Boday D.J. Loy D.A. Poly aniline nanofiber/silica aerogel composites with improved strength and sensor applications. Polymer Preprints, (2009), 50, p. 282.
87. Aegerter M.A., Leventis N., Koebel M.M. Aerogels Handbook. Advances in Sol-Gel Derived Materials and Technologies. Springer, (2011), 956 p.
88. Cooper P.W. Explosives Engineering. New York: Wiley-VCH (1996).
89. Beylin D.A. Borisov Yu.M., Figovsky O.L., Surovtsev I.S., Patent RF 2408552, Наноструктурирующее связующее для композиционных строительных материалов, (2009), 7 p.
90. Фиговский О.Л., Бейлин Д.А., Пономарев А.Н. Успехи применения нанотехнологий в строительных материалах, Нанотехнологии в строительстве, №3, (2012), с. 6-21.
91. Carlson P. Aerogel Cherenkov counters: construction principles and applications. Nucl. Instrum. Methods Phys. Res., (1986), Sect A248, pp. 110–117.
92. Gunter P. Aerogel Cherenkov counters at DESY. Nucl Instr. and Meth., (1986), A248, pp.118–129
93. Woignier T., Phalippou J., and Prassas M. Glasses from aerogels part 2: The aerogel glass transformation. J. Mater. Sci., (1990), 25 pp. 3118–3126.
94. Zanotto E.D. The formation of unusual glasses by sol-gel processing. J. Non-Cryst. Solids, (1992), 147&148, pp. 820–823
95. Woignier T., Reynes J., Phalippou J., Dussossoy J.L., Jacquet-Francillon N. Sintered silica aerogel: a host matrix for long live nuclear wastes. J. Non-Cryst. Solids, (1998), 225, pp. 353–357
96. Gash A.E., Satcher J.H., Simpson R.L. Direct preparation of nanostructured energetic materials using sol-gel methods. In Miziolek, AW, Karna Sp, Mauro JM, Vaia Ra (Eds.) Defense applications of nanomateirals. Washington DC : American Chemical Society, (2002).
97. Dagani R. Putting the nano into composites. Chemical & Engineering News, (1999), 77, pp. 25–31.
98. Wickersham C.E., Poole J.E. Explosive Crystallization in Zr/Si Multilayers. J. Vac. Sci. Technol. A, (1988), 6, 3, pp. 1699–1702.
99. Bockman B.S., Pantoya M.L., Son S.F., Asay B.W., Mang J.T. Combustion velocities and propagation mechanisms of metastable interstitial composites. Journal of Applied Physics, (2005), 98, 6, pp. 064903/1-064903/7.
100. Umbrajkar S.M., Schoenitz M., Dreizin E.L. Structural refinement in Al-MoO3 nanocomposites prepared by arrested reactive milling. Thadhani N, Armstrong RW, Gash AE, Wilson WH Materials Research Society Symposium Proceedings Vol. 896; Multifunctional Energetic Materials. Warrendale PA (USA): Material Research Society (2005).
101. Son S.F., Yetter Y.A., Yang V. Introduction: Nanoscale energetic materials. Journal of Power and Propulsion and Power, (2007), 23, 4, pp.643–644.
102. Aumann C.E., Skofronick G.L., Martin J.A. Oxidation behavior of aluminum nanopowders. J. Vac. Sci. Technol. B. (1993), 13, 2, pp.1178–1183.
103. Armstrong R.W., Coffey C.S., DeVost V.F., Elban W.L. Crystal size dependences for the impact initiation of cyclotrimethylenetrimitramine explosive. J. Appl. Phys., (1990), 68, pp. 979–984.
104. Rodriguez R., Herrera R., Archer L.A., Giannelis E.P. Nanoscale Ionic Materials, Advanced Materials, Vol. 20, 22, (2008), pp. 4353–4358, DOI: 10.1002/adma.200801975.
105. Mascia L, Tang T. Polyperfluoroether-silica hybrids, Polymer, (1998), Vol. 39, 14, pp. 3045–3057
106. Delozier D.M., Orwoll R.A., Cahoon J.F., Ladislaw J.S., Smith J.G., Connell J.W. Polyimide nanocomposites prepared from high-temperature, reduced charge organoclays, Polymer, (2003), Vol. 44, 8, pp. 2231–2241.
107. Dennis H.R., Hunter D.L., Chang D., Kim S., White J.L., Cho J.W., Paul D.R.. Effect of melt processing conditions on the extent of exfoliation in organoclay-based nanocomposites, Polymer,
(2001), Vol. 42, 23, P. 9513–9522.
108. Шабанова Н.А., Попов В.В., Саркисов П.Д. Химия и технология нанодисперсных оксидов - М., Академкнига, 2006.
109. Пахомов Н.А. Научные основы приготовления катализаторов, Новосибирск: НГУ, (2010), 278 с.
110. Шабанова Н.А., Саркисов П.Д. Основы золь-гель технологии нанодисперсного кремнезема - М., Академкнига, (2004).
111. Figovsky O., Borisov Yu., Beilin D. Nanostructured Binder for Acid-Resisting Building Materials, J. Scientific Israel-Technological Advantages. (2012), Vol. 14. № 1. P. 7–12.
112. Figovsky O.L., Karchevsky V., Romm F. Conductive Coatings Based on Quaternary Ammonium Silicates, ORGANIC-INORGANIC HYBRIDS II. Science, Technology, Applications, University of Surrey, Guildford, UK, (2002), p.11.
113. Figovsky O., Beilin D., Leykin A. Advanced patented protective nanomaterials and coatings, International Letters of Chemistry, Physics and Astronomy, v.10, N1, (2013), p.102-109.
114. Брик М.Т. Энциклопедия мембран, в 2 томах, "Киево-Могилёвская академия", 2005, 660 с.
115. Figovsky O.L., Karchevsky V., Beilin D., Aksenov O. Advanced Waterborne Fire Protective and Heat Retarded Coating Compositions, Organic-Inorganic Hybryds II. Science, Technology, Applications, University of Surrey, Guildford, UK, (2002), p.16.
116. Кочаров Р.Г., Каграманов Г.Г. Расчет установок мембранного разделения жидких смесей, РХТУ им. Д. И. Менделеева. — М., (2001), 128 с.
117. Romm F.A., Figovsky O.L. Statistical Polymer Method Modeling of Macromolecules and Aggregates with Branching and Crosslinking, Formed in Random Processes, Discrete Dynamics in Nature and Society, (2002), Vol. 2, pp. 203-208.
118. Максимов А.И., Мошников В. А., Таиров Ю. М., Шилова О. А. Основы золь-гель-технологии нанокомпозитов. Издательство СПбГЭТУ "ЛЭТИ", (2007), 273 с.
119. Асеев А.Л. Наноматериалы и нанотехнологии для современной полупроводниковой электроники. Российские нанотехнологии. Обзоры. (2006), N1-2, с.97-110.
120. Shamiryana D., Abellb T., Iacopia F., Maex K. Low-k dielectric materials, Materials Today, Vol. 7, 1, (2004), P. 34–39.
121. Samuelson L. Self-forming nanoscale devices, Materials today, (2003), N10, p.22-31.
122. Thelander C., Agarwol P., Brongersma S et al Nanowire-based one dimensional electronics, Materials today, (2006), N10, p.28-35.
123. Yat Li, Fang Qian, Jie Xiang, Lieber M. Nanowire electronic and optoelectronic devices, Materials today, (2006), N10, p.18-27.
124. Patolsky F., Lieber M. Nanowire nanosensors/Materials today, (2005), N4, p.20-28.
125. Takahashi Y„ Kobayashi I., Noguchi M., Hirai N„ Nakanishi K„ Hattori M. Water purifying apparatus. EP 504597. AO 1K63/04, (1992).
126. Self-setting aqueous mixtures for the manufacture of chemically resistant materials, and their manufacture and use. (Woellner-Werke GmbH und Co.) DE 4104596, C04B28/24, (1992).
127. Kubota Y., Helmkamp M.M., Zones S.I., Davis M.E. Properties of organic cations that lead to the structure-direction of high-silica molecular sieves. Microporous Materials, (1996), 6, 4, 213-229.
128. Westall S. Process for producing organosiloxanes. EP 587343, C08G77/08, (1994).
129. Kaliski A.F. Aggregated titania pigment products. PCT Inst. Appl. WO 93 01883, B01J13/00, (1993).
130. Gutfraind R., Sheintuch M. Scaling approach to study diffusion and reaction processes on fractal catalysts. Chem. Engng. Sci., (1992), 47, 17-18, pp. 4425-4433.
131. Coppens M.O., Froment G.F. A comparison of reaction rates in mass fractal and nonfractal catalysts. Fractal Chaos Chem. Eng., Proc. Int. CFIC 96 Conf. (1997), Meeting Date 1996, Publisher: World Scientific, Singapore, 15-26.
132. Avnir D., Farin D., Pfeifer P. A discussion of some aspects of surface fractality and of its determination. New J. Chem. (1992), 16(4), 439-449.
133. Romm F. Thermodynamics of microporous material formation. In: Surfactant Science Series "Interfacial forces and fields: Theory and applications" (Monographic series, Editor: Jyh-Ping Hsu), Chapter 2, pp. 35-80. Marcel Dekker, Inc. (1999).
134. Romm F. Derivation of the Equations for Isotherm Curves of Adsorption on Microporous Gel Materials, Langmuir, (1996), 12, 14, pp. 3490-3497.
135. Pauzauskie P.J., Peidong Yang. Nanowire photonics/Materials today (2006), N10, p.36-45.
136. Комаров В.С., Ратько А.И. Адсорбенты: получение, структура, свойства, Минск: Беларус., Навука, 2009, 256 с.
137. Flörke O.W., et al. "Silica" in Ullmann's Encyclopedia of Industrial Chemistry, 2008, Weinheim: Wiley-VCH. doi:10.1002/14356007.a23_583.pub3.
138. 158. Zvereva N.A., Val’tsifer V.A. Computer simulation of the structure of disperse systems by the particle method. Journal of Engineering Physics and Thermophysics, Vol. 75, No. 2, (2002).
139. Вальцифер В.А., Зверева Н.А.. Компьютерное моделирование реологического поведения суспензии. Мат. моделирование. (2004), т.16, №3, с.57-62
140. Val’tsifer V.A., Zvereva N.A. Statistical packing of equal spheres. Advanced Powder Technology, Vol.10, N4, (1999), pp. 399-403
141. Tselishchev Yu.G, Val’tsifer V.A. Influence of the Type of Contact between Particles Joined by a Liquid Bridge on the Capillary Cohesive Forces. Colloid Journal, Vol. 65, No. 3, (2003), pp. 385–389.
142. Целищев Ю.Г, Вальцифер В.А., Стрельников В.Н. Исследование структурообразования микро дисперсного наполнителя в олигомерных композициях при течении. Журнал прикладной химии. (2010), Т. 83, 8, p1288
143. Val’tsifer V.A, Gubina N.A. Rheological and Electrical Properties of an Oligomeric Formulation as Influenced by Fractional Composition of Conducting Filler. Russian Journal of Applied Chemistry, Vol. 76, No. 10, (2003), pp. 1659-1661.
144. Гаришин O.K. Геометрический синтез и исследование случайных структур // Структурные механизмы формирования механических свойств зернистых полимерных композитов. - Екатеринбург: УрО РАН, (1997), С. 48-81.
145. Зайцев А.В., Лукин А.В., Трефилов Н.В.. Статистическое описание структуры двухфазных волокнистых композитов. Математическое моделирование систем и процессов. (2002), №10, с.52-62.
146. Берлин А.А., Ротенбург Л., Басэрст Р. Особенности деформации неупорядоченных полимерных и неполимерных тел, Высокомолек. соединения. Сер. А. (1992), Т. 34, № 7. С. 6-32.
147. Гаришин О.К., Корляков А.С. Моделирование механического взаимодействия между частицами наполнителя и связующим в полимер-силикатных нанокомпозитах при конечных макродеформациях. Вычислительная механика сплошных сред. – (2008), Т. 2, № 3. C.25-33.
148. Fengge G. Clay/polymer composites: the story, Materials Today, (2004), No. 11, pp. 50–55.
149. Sheng N., Boyce M.C., Parks D.M., Rutledge G.C. [et al.]. Multiscale micromechanical modeling of polymer/clay nanocomposites and the effective clay particle /, Polymer, (2004), Vol. 45, pp. 487–506.
150. Гаришин О.К., Морозов И.А., Шадрин В.В. Экспериментальные исследования полимер-силикатных нанокомпозитов. Вестник ПНИПУ Механика, (2013), 2, С.84-95
151. Garishin O.K., Svistkov A.L., Gerasin V.A., Guseva M.A. Simulation of the Elastic–Plastic Behavior of PolyolefinBased Nanocomposites with a Different Structure of Layered Filler. Polymer Science, Ser. A, (2009), Vol. 51, No. 4, pp. 407–415.
152. Manitiu, R.J. Bellair, S. Horsch, E. Gulari [et al.]. Supercritical Carbon Dioxide-Processed Dispersed PolystyreneClay Nanocomposites / M. // Macromolecules. (2008), Vol. 41, 21, pp. 8038–8046.
153. Чвалун С.Н. Полимерные нанокомпозиты, Природа. (2000), № 7, С. 22–30.
154. Garishin O.K., Gerasin V.A., Guseva M.A. Simulation of the Elastic–Plastic Behavior of PolyolefinBased Nanocomposites with a Different Structure of Layered Filler1Polymer Science, Ser. A, (2011), Vol. 53, No. 12, pp. 1187–1197.
155. Олейник Э.Ф. Пластичность частично кристаллических гибкоцепных полимеров на микро- и мезоуровнях // Высокомолекулярные соединения (2003), Т. 45, № 10. С. 1-129.
156. Fengge G. Clay/polymer composites: the story. Materials Today. (2004), № 11, pp. 50-55.
157. Sheng N., Boyce M.C., Parks D.M., Rutledge G.C., Abes J.I., Cohen R.E. Multiscale micromechanical modeling of polymer/clay nano-composites and the effective clay particle // Polymer. (2004), Vol. 45, pp.487-506.
158. Garishin O. K., Lebedev S. N. Simulation of elastic and plastic properties of polymeric composites with silicate lamellar nanofillerna. NOSYSTEMS PHYSICS, CHEMISTRY, MATHEMATICS, (2011), 2 (2), P. 71–75.